Химия – один из основных предметов в школьной программе, который изучает строение, свойства и превращения веществ. В ходе изучения металлов в 9 классе, ученики знакомятся с таким понятием, как цепочки превращений. Цепочка превращений - это последовательность реакций, которые происходят при взаимодействии различных веществ. Знание этих цепочек является основополагающим для понимания металлургических и химических процессов и их применения в промышленности.
Цепочки превращений по химии 9 класса помогают ученикам разобраться в химическом взаимодействии металлов с кислотами, щелочами, солями и другими веществами. Знание таких цепочек не только дает понимание превращений веществ, но и помогает на практике – например, при выборе подходящего материала для изготовления деталей, контейнеров или сооружений.
Ниже приведены цепочки превращений по химии 9 класса: металлы с ответами. Запомните эти превращения и вы сможете легко применять их на практике, а также успешно выполнять лабораторные работы и задания по химии:
Цепочка превращений для металлов солями:
Металл + Соль → Металл + Кислота → Металлическая соль + Водород
(Пример: Железо + Соль → Железо + Кислота → Железная соль + Водород)
Цепочка превращений для металлов щелочью:
Металл + Щелочь → Соль щелочью + Водород
(Пример: Калий + Щелочь → Калиевая соль + Водород)
Цепочка превращений для металлов кислотой:
Металл + Кислота → Соль + Водород
(Пример: Магний + Кислота → Магниевая соль + Водород)
Запомните эти простые цепочки превращений и применяйте их при решении учебных задач и на практике. Это поможет вам лучше разобраться в свойствах и превращениях металлов и успешно проходить уроки по химии в 9 классе.
Основные понятия химии металлов
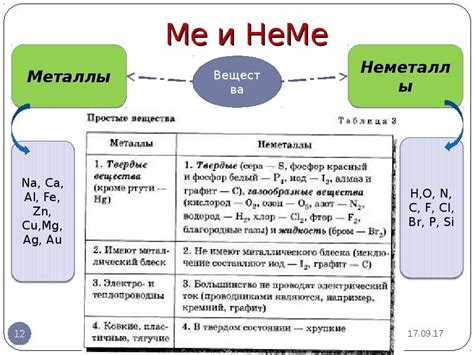
Химия металлов изучает особенности и свойства металлических элементов в химических реакциях. Металлы в химии обладают рядом особых характеристик. Например, они проявляют металлический блеск и относительно легко проводят электрический ток и тепло. Также металлы способны образовывать между собой сплавы, то есть смеси двух или более металлов.
Процесс, при котором металлы превращаются в другие химические соединения, называется реакцией металла с кислотой. Такие реакции можно проводить с различными кислотами, включая соляную, серную и азотную. При этом происходит образование соответствующей соли и выделение водорода.
Свойства металлов также зависят от их положения в периодической системе элементов. Например, щелочные металлы, такие как натрий и калий, являются очень реактивными и легко взаимодействуют с водой. А тяжелые металлы, такие как свинец и ртуть, являются токсичными и могут накапливаться в организме, что ведет к отравлениям.
Металлы могут быть использованы в различных областях, включая строительство, электротехнику, медицину и производство автомобилей. Например, алюминий является легким и прочным материалом, поэтому он широко применяется в самолетостроении и автомобилестроении. А железо используется для производства стальных конструкций и различных металлических изделий.
Взаимодействие металлов с кислотами
Металлы - это элементы, обладающие химическими свойствами взаимодействовать с кислотами. В результате такого взаимодействия металлы образуют соли и выделяются водород. Данная реакция особенно интенсивна, если металл находится в активном состоянии.
Взаимодействие металлов с кислотами может происходить по разным механизмам. Например, при взаимодействии металлов с солями кислот образуется соль металла и выделяется водород. Если кислота является двухосновной, то в реакции участвуют две молекулы кислоты и образуются две молекулы соли металла.
Некоторые металлы, такие как цинк и железо, обладают амфотерными свойствами, что позволяет им реагировать с различными типами кислот. Например, цинк может реагировать как с минеральными кислотами (сольной кислотой, серной кислотой), так и с органическими (уксусной, лимонной). Это позволяет использовать цинк при удалении ржавчины с поверхности металлов.
При взаимодействии некоторых металлов с кислотами может происходить выделение водорода, который может использоваться в промышленных процессах, например, в производстве водородных топливных элементов.
Взаимодействие металлов с кислотами является важным процессом в химии и имеет широкое применение в различных областях науки и техники.
Металлы и основания

Основания - это химические соединения, которые способны образовывать ион гидроксида (OH-) при растворении в воде. Металлы часто используются в качестве оснований, так как они обладают способностью отдавать электроны и реагировать с водой.
Металлы, такие как натрий, калий и кальций, реагируют с водой, образуя щелочные растворы. Например, натрий реагирует с водой, образуя гидроксид натрия (NaOH) и высвобождая водород (H2). Эта реакция представляет собой типичный пример реакции металла с водой.
Однако не все металлы реагируют с водой. Некоторые металлы могут реагировать только с кислотами, образуя соли. Например, цинк реагирует с соляной кислотой, образуя хлорид цинка (ZnCl2) и высвобождая водород.
Металлы, такие как магний и алюминий, могут реагировать и с основаниями, образуя соли. Например, магний реагирует с гидроксидом натрия (NaOH), образуя гидроксид магния (Mg(OH)2) и высвобождая натрий.
Таким образом, металлы могут играть роль оснований и образовывать соли при реакции с кислотами и основаниями. Изучение этих реакций важно для понимания роли металлов в химических процессах.
Цепочки превращений в реакциях солей металлов
Реакции солей металлов являются одним из основных разделов химии и важны для понимания процессов, происходящих при химических превращениях. В ходе этих реакций происходит цепочка превращений, в результате которой исходное соединение претерпевает изменения и образуется новое вещество.
Цепочка превращений может начинаться с реакции диссоциации соли металла в растворе. Диссоциация – это процесс распада молекулы или иона на ионы в растворе. Например, соль хлорида натрия (NaCl) при диссоциации распадается на ионы натрия (Na+) и хлора (Cl-).
Далее в цепочке превращений может произойти реакция обмена лигандов или замещения иона металла в растворе. В результате этой реакции происходит замещение одного иона металла на другой. Например, ион железа (Fe2+) может замещать ион меди (Cu2+), что приводит к образованию нового соединения – соли железа, а ион меди остается в растворе.
Затем цепочка превращений может продолжаться с реакцией осаждения, при которой ионы металла соединяются с нерастворимым веществом и выпадают в виде осадка. Например, ионы железа (Fe3+) могут реагировать с ионами гидроксида (OH-) и образовывать гидроксид железа (Fe(OH)3) – нерастворимое вещество, которое выпадает в виде осадка из раствора.
Примеры заданий и ответы по химии металлов

1. Какие металлы могут вступать в реакцию с кислородом и образовывать оксиды?
Ответ: Железо, алюминий, медь, цинк, олово и др.
2. Какие металлы обладают высокой химической активностью и могут сильно реагировать с кислотами?
Ответ: Натрий, калий, магний, кальций и др.
3. Какой металл имеет способность образовывать стойкий оксидную пленку на поверхности своей металлической пластины?
Ответ: Алюминий
4. Какие металлы обладают способностью образовывать соль при взаимодействии с кислородом в присутствии воды?
Ответ: Натрий, калий, магний и др.
5. Какой металл широко используется в производстве электротехнических изделий и имеет высокую электропроводность?
Ответ: Медь
6. Какой металл является одним из самых распространенных в природе и широко используется в строительстве и производстве автомобилей?
Ответ: Железо
Вопрос-ответ
Какие цепочки превращений происходят с металлами в химии 9 класс?
Цепочки превращений с металлами в химии 9 класс могут включать процессы окисления, восстановления, образования солей, соединений с кислородом и серой, а также реакции с кислотами и щелочами.
Какие реакции превращения металлов в соли происходят в химии 9 класс?
В химии 9 класс рассматриваются реакции превращения металлов в соли, такие как реакции с кислотами, при которых образуются соли металлов, и реакции замещения, при которых один металл вытесняет другой из его соли.
Какие реакции превращения металлов происходят с кислородом и серой?
Металлы могут реагировать с кислородом и серой, образуя соответствующие оксиды и сульфиды. Например, железо при нагревании воздухе окисляется до образования оксида железа, а серебро может реагировать с серным газом, образуя серебряный сульфид.
Какие реакции превращения металлов происходят с щелочами?
Некоторые металлы могут реагировать с щелочами, образуя гидроксиды металлов и выделяяся водород. Например, натрий реагирует с щелочью, образуя гидроксид натрия и выделяясь водородный газ.
