Металлы являются одной из основных классифицирующих групп химических элементов в периодической системе Д.И. Менделеева. Всего существует около 90 металлов, и все они различаются в своей химической активности и свойствах. Однако металлы можно разделить на несколько основных групп в соответствии со своими атомными и электронными свойствами.
1. Алкальные металлы: в эту группу входят литий, натрий, калий, рубидий, цезий и франций. Они отличаются низкой плотностью, мягкостью и низкой температурой плавления. Алкальные металлы очень активны химически и реагируют с водой и кислородом. Они также обладают хорошими электропроводностью и теплопроводностью.
2. Щелочноземельные металлы: эта группа включает бериллий, магний, кальций, стронций, барий и радий. Щелочноземельные металлы также обладают низкой плотностью и химической активностью, но они менее активны, чем алкальные металлы. Они тем не менее обладают схожими свойствами, такими как электропроводность и теплопроводность.
3. Переходные металлы: эта группа включает большинство элементов из блока d в периодической системе. Они характеризуются переменным количеством внешних электронов и образуют различные ионы. Переходные металлы обладают хорошими электропроводностью и теплопроводностью, а также имеют высокую плотность и твердость. Они обладают разнообразными химическими свойствами и часто используются в различных отраслях промышленности.
Разделение металлов на группы основывается на их электронной конфигурации и химических свойствах. Это помогает лучше понять их строение и взаимодействие с другими элементами. Знание этих групп может быть полезно для понимания различных физических и химических процессов, связанных с металлами.
Понятие "электронное семейство"

Электронное семейство металлов – группа характеристик, которые связаны с электронной структурой атомов металлов и оказывают существенное влияние на их химические свойства и способность образовывать соединения. Понимание электронных семейств помогает классифицировать металлы и предсказывать их поведение в различных химических реакциях.
Основной параметр, определяющий электронное семейство металла, это электронная конфигурация его атома. Электронная конфигурация определяет расположение электронов в энергетических уровнях и подуровнях атомного оболочки. Она указывает на то, сколько электронов содержится на каждом энергетическом уровне и в каждом подуровне атома металла.
Электронное семейство металла определяет его свойства, в частности, электропроводность, теплопроводность и светопроводность. Электроны, находящиеся на внешнем энергетическом уровне, называемом валентной оболочкой, определяют химическую активность металла и его способность образовывать соединения с другими элементами.
Металлы делятся на различные электронные семейства в зависимости от числа электронов в валентной оболочке. Некоторые металлы имеют одноэлектронные валентные оболочки, такие как алкалии и щелочноземельные металлы, в то время как другие металлы имеют полностью заполненные валентные оболочки, как например металлы позднего периода таблицы Менделеева.
Семейство благородных металлов
Семейство благородных металлов включает в себя несколько элементов периодической таблицы – платину (Pt), золото (Au), серебро (Ag) и родий (Rh). Они относятся к одной группе в таблице, так как обладают схожими химическими свойствами.
Благородные металлы являются очень устойчивыми к окислению и коррозии, что делает их ценными в промышленности и ювелирном деле. Они обладают высокой плотностью и тугоплавкостью, а также отличаются хорошей проводимостью электричества и тепла.
Золото – наиболее известный и распространенный из благородных металлов. Оно используется для создания ювелирных украшений, монет, электронных компонентов и в других отраслях промышленности. Платина также широко применяется в ювелирном деле, а также в химической промышленности, каталитических процессах и электронике.
Серебро используется как материал для посуды и украшений, а также в фотографической индустрии, электронике и производстве зеркал. Родий, в свою очередь, находит применение в каталитических реакциях, ювелирной индустрии и производстве автомобильных катализаторов.
Семейство благородных металлов имеет большую важность в различных областях науки и промышленности, благодаря своим уникальным свойствам и применению в различных технологиях.
Химические свойства благородных металлов

Благородные металлы, такие как платина, золото и серебро, обладают уникальными химическими свойствами, которые делают их ценными и востребованными материалами в различных отраслях промышленности. Они имеют высокую степень устойчивости к химическим реакциям, что делает их неподверженными коррозии и окислению.
Один из главных признаков благородных металлов - их способность служить катализаторами. Это означает, что они могут ускорять химические реакции, не вступая в сами реакции. Благородные металлы используются в катализе различных промышленных процессов, таких как производство удобрений, нефтепереработка и промышленное производство кислорода.
Благородные металлы также являются отличными проводниками электричества и тепла. Их электропроводность является одной из главных причин, почему они широко используются в электронике и электротехнике. Кроме того, благородные металлы обладают высоким плавлением и пуансоновской температурой, что делает их идеальными для использования в процессах сварки и лития металлов.
Еще одним важным химическим свойством благородных металлов является их устойчивость к окрашиванию. Они не тускнеют со временем и сохраняют свой блеск и металлический оттенок даже при длительном воздействии окружающей среды. Это делает благородные металлы популярными в ювелирной и часовой индустрии, а также в производстве зеркал и других оптических приборов.
Семейство щелочных металлов
Семейство щелочных металлов включает в себя элементы первой группы периодической системы. Оно состоит из лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Щелочные металлы имеют характерные физические и химические свойства, что делает их уникальными и полезными в различных отраслях науки и промышленности.
Одной из ключевых характеристик щелочных металлов является их низкая плотность. Литий является самым легким металлом, а калий и натрий также относятся к легким элементам. Это делает щелочные металлы привлекательными для применения в аэронавтике и других областях, где важна низкая масса материала.
Щелочные металлы обладают высокой химической активностью из-за своей низкой ионизационной энергии. Они легко образуют ионы положительного заряда, что позволяет им образовывать стабильные и прочные соединения с другими элементами. Это делает щелочные металлы важными в химической промышленности и фармацевтике, где они используются в процессе синтеза и производства различных соединений и препаратов.
Одним из самых важных применений щелочных металлов является их использование в батареях. Литиевые и щелочно-ионные аккумуляторы широко применяются в электрических устройствах, таких как мобильные телефоны, ноутбуки и электромобили. Благодаря своей высокой энергетической плотности и стабильности, щелочные металлы обеспечивают долгое время работы устройств и быструю зарядку.
В целом, семейство щелочных металлов играет важную роль в нашей жизни и научных исследованиях. Эти элементы имеют широкий спектр применений, от промышленности и энергетики до медицины и высоких технологий.
Химические свойства щелочных металлов
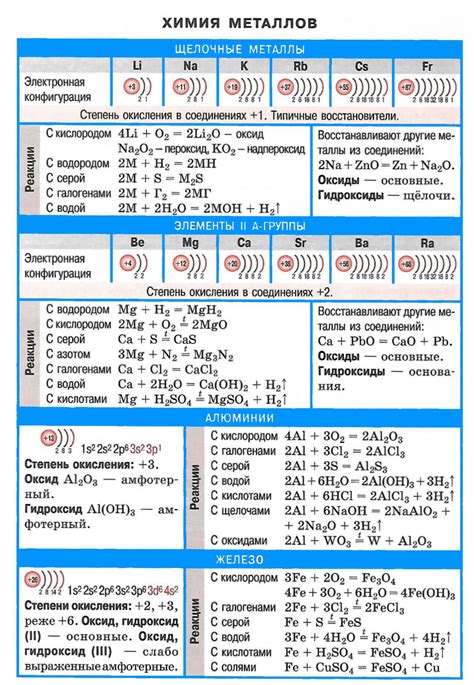
1. Активность: Щелочные металлы - наиболее активные металлы в периодической системе. Они легко реагируют с водой, кислородом и некоторыми другими веществами, что делает их химически очень реактивными.
2. Способность образовывать ионы: Щелочные металлы образуют положительно заряженные ионы, с катионами, имеющими единичный положительный заряд. Эти ионы обладают значительной стабильностью и с легкостью участвуют в химических реакциях.
3. Взаимодействие с водой: Щелочные металлы реагируют с водой, образуя гидроксиды, которые являются сильными щелочами. Реакция происходит с выделением водорода и образованием гидроксидного иона.
4. Взаимодействие с кислородом: Щелочные металлы реагируют с кислородом, образуя оксиды. Эти оксиды обладают щелочными свойствами и образуют гидроксиды при контакте с водой.
5. Образование амфотерных соединений: Щелочные металлы могут образовывать амфотерные соединения, которые проявляют как кислотные, так и щелочные свойства. Это связано с их способностью образовывать различные ионы в химических реакциях.
6. Подвижность ионов: Ионы щелочных металлов обладают высокой подвижностью, что способствует их участию в электролитических реакциях и влияет на их реакционную способность.
Химические свойства щелочных металлов обусловлены специфической структурой и электронной конфигурацией их атомов. Они играют важную роль во многих отраслях науки и техники, используются в производстве различных материалов, а также находят применение в медицине и фармакологии.
Семейство щелочноземельных металлов
Семейство щелочноземельных металлов включает в себя шесть элементов: магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra) и рундий (Rd). Эти металлы расположены во второй группе периодической системы и характеризуются сходными свойствами.
Щелочноземельные металлы являются активными химическими элементами, отдающими два электрона во внешней электронной оболочке. Они обладают низкой плотностью, низкой температурой плавления и кипения, а также мягкостью и хорошей пластичностью.
Эти металлы обладают хорошей электропроводностью и теплопроводностью, что делает их полезными в промышленности. Щелочноземельные металлы также имеют способность образовывать стабильные ионные соединения, в особенности оксиды и гидроксиды.
Семейство щелочноземельных металлов химически активно и обладает разнообразными химическими свойствами. Например, магний используется в производстве сплавов и легировании металлов, а кальций широко применяется в строительстве и медицине.
Щелочноземельные металлы встречаются в природе в виде соединений, таких как карбонаты и сульфаты, и имеют высокую реактивность, особенно с водой. При контакте с водой они образуют щелочные оксиды и гидроксиды, выделяя водород.
Химические свойства щелочноземельных металлов

Щелочноземельные металлы - группа химических элементов, которые расположены во второй группе периодической системы Д.И. Менделеева. В эту группу входят бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Щелочноземельные металлы обладают рядом уникальных химических свойств, которые делают их полезными и широко применяемыми в различных областях.
Во-первых, щелочноземельные металлы имеют низкую электроотрицательность, что делает их реактивными в химических реакциях. Они образуют ковалентные и ионные соединения с другими элементами. Например, бериллий образует бериллийоксид (BeO), который является керамическим материалом с высокими температурными стабильностью и теплопроводностью.
Во-вторых, щелочноземельные металлы обладают высокой электропроводностью и используются в различных электрических и электронных устройствах. Например, магний используется в производстве легких сплавов для авиационной промышленности, а кальций используется в производстве карбида кальция для применения в садоводстве и агрокультуре.
В-третьих, щелочноземельные металлы обладают способностью образовывать соли с кислотами. Это делает их важными в области пищевой и фармацевтической промышленности. Например, барий используется в производстве контрастных средств для рентгенологии, а стронций находит применение в лечении рака кости.
В-четвертых, щелочноземельные металлы играют важную роль в биологии. Они являются необходимыми микроэлементами для здоровья растений и животных. Например, кальций является основным строительным компонентом костей и зубов у человека, а магний необходим для работы нервной системы и мышц.
Таким образом, щелочноземельные металлы обладают уникальными химическими свойствами, которые делают их незаменимыми во многих сферах жизни человека. Их использование находит применение как в промышленности, так и в медицине и биологии.
Семейство переходных металлов
Переходные металлы - это элементы, расположенные в середине периодической таблицы, между группами 2 и 3-12. Они отличаются своей химической активностью и электронной структурой.
Электронная структура переходных металлов характеризуется наличием электронов в d-орбиталях своего атома. Это позволяет им образовывать разнообразные соединения с другими элементами и участвовать в реакциях.
Химические свойства переходных металлов обусловлены их способностью образовывать различные оксидационные состояния. Они могут иметь несколько различных зарядов, что позволяет им участвовать в разнообразных химических реакциях.
Переходные металлы обладают высокой термостабильностью, высокими температурами плавления и кипения. Они образуют прочные сплавы, имеют высокую прочность и твердость. Их основные свойства позволяют использовать их в различных областях, включая электротехнику, строительство, металлургию и многие другие.
Семейство переходных металлов включает такие элементы, как железо, титан, никель, цинк, хром, медь, кобальт и многие другие. Они широко применяются в различных отраслях промышленности, науке и технологии благодаря своей универсальности и полезным свойствам.
Вопрос-ответ
Какие семейства металлов относятся к электронным группам?
К электронным семействам металлов относятся две группы - 1B (медные монеты) и 8B (железные монеты).
Почему электронные семейства металлов относятся к группам 1B и 8B?
Электронные семейства металлов относятся к группам 1B и 8B потому, что они имеют одинаковую структуру электронных оболочек. В этих группах у металлов на внешней энергетической уровне находится один электрон, что делает их взаимодействие с другими элементами и свойства подобными.
В чем состоит значение электронных семейств металлов?
Электронные семейства металлов имеют большое значение для понимания и классификации элементов. Они позволяют упорядочить химические элементы в соответствии с их свойствами и строением электронных оболочек, что помогает в изучении химических реакций и разработке новых материалов.
Есть ли другие электронные семейства металлов, кроме 1B и 8B?
Да, помимо электронных семейств металлов 1B и 8B, существует множество других семейств, к которым относятся металлы. Например, 2B (цинковые монеты) и 13B (алюминий). Каждое из этих семейств имеет свои характерные особенности и свойства.
Какие металлы относятся к семейству 1B?
К семейству 1B относятся такие металлы, как медь (Cu), серебро (Ag) и золото (Au). Они имеют одинаковое строение электронных оболочек, а именно один внешний электрон на s-подуровне, что делает их схожими по химическим свойствам и взаимодействию с другими элементами.
Какие металлы относятся к семейству 8B?
К семейству 8B относятся металлы железо (Fe), рутений (Ru), осмий (Os) и хафний (Hf). Все они имеют внешнюю электронную оболочку 5d, что делает их химически схожими и позволяет объединять их в одно семейство.
