Электроотрицательность – это химическая характеристика элементов, определяющая их способность притягивать электроны в химической связи. Принципиальное значение электроотрицательности заключается во взаимодействии элементов в химических реакциях и образовании соединений. Одним из самых электроотрицательных элементов является водород.
Водород занимает первое место в периодической системе элементов и его электроотрицательность составляет 2,20 по шкале Полинга. Металлы же, в свою очередь, имеют намного более низкую электроотрицательность, что обусловлено особенностями их электронной структуры и химических связей.
Причины такой разницы в электроотрицательности между водородом и металлами связаны с положением этих элементов в периодической системе и их электронной конфигурацией. Водород относится к неметаллам, а металлы – к другой группе элементов, в которую входят щелочные ищелочноземельные металлы, переходные металлы и др.
Водород имеет один электрон в внешней оболочке, что делает его электроотрицательность высокой и создает основу для образования химических связей с другими элементами.
Высокая электроотрицательность водорода имеет ряд последствий. Во-первых, это обуславливает его способность образовывать различные химические соединения, такие как воды, кислородные кислоты и др. Именно эти свойства водорода позволяют ему играть важную роль во многих процессах, в том числе в биохимии и энергетике.
Во-вторых, высокая электроотрицательность водорода обусловливает его особую реакционную способность в химических реакциях, что находит применение во многих областях науки и техники.
Электроотрицательность водорода: причины и последствия
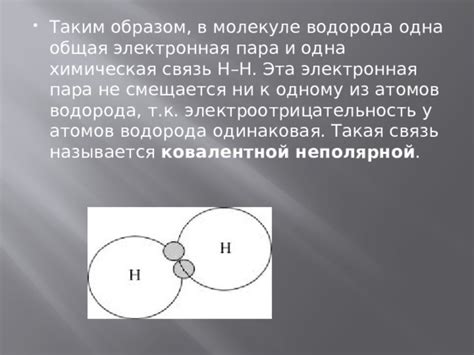
Электроотрицательность — это свойство атомов притягивать электроны в химических связях. В случае водорода, его электроотрицательность выше, чем у металлов.
Главная причина такой высокой электроотрицательности водорода заключается в его строении атома. Водород состоит из одного протона и одного электрона. Количество протонов и электронов в атоме водорода одинаковое, что делает его нейтральным. Однако, электрон в атоме водорода находится ближе к ядру, что приводит к его высокой положительной заряде и, следовательно, высокой электроотрицательности.
Высокая электроотрицательность водорода оказывает влияние на химические свойства и реактивность этого элемента. Водород является сильным окислителем и может образовывать стабильные соединения с другими элементами, например, кислородом или хлором.
Также стоит отметить, что высокая электроотрицательность водорода позволяет ему образовывать водородные связи. Водородные связи — это силы притяжения между водородным атомом и электронными облаками других атомов. Они являются одним из важных факторов в молекулярных структурах и способны значительно влиять на физические свойства вещества.
Причины высокой электроотрицательности водорода
Высокая электроотрицательность водорода обусловлена его атомной структурой и положением в периодической системе элементов. Атом водорода состоит из одного протона и одного электрона, их взаимодействие определяет электроотрицательность элемента.
Однако главным фактором, влияющим на электроотрицательность водорода, является его положение в периодической системе элементов. Водород находится в верхнем левом углу таблицы Менделеева, что свидетельствует о его высокой электроотрицательности.
Высокая электроотрицательность водорода обусловлена также его способностью принимать и отдавать электроны. Водород может электроотрицательность ощутимо изменять свою окружающую среду, образуя различные соединения и ионы.
Электроотрицательность водорода имеет важное значение в химии и физике. Она определяет его способность образовывать связи с другими элементами и взаимодействовать с ними. Высокая электроотрицательность водорода позволяет ему эффективно участвовать в реакциях, что делает его одним из важнейших элементов в химической промышленности.
Сравнение электроотрицательности водорода и металлов

Электроотрицательность является важной характеристикой элементов, определяющей их способность притягивать электроны в химических связях. Она обычно варьирует от 0 (для самых электроотрицательных элементов) до 4 (для самых электроотрицательных).
Водород обладает наиболее высокой электроотрицательностью среди всех элементов и его значение составляет 2,2 по шкале Полинга. Это означает, что водород обладает большей способностью притягивать электроны, чем металлы.
Причина высокой электроотрицательности водорода связана с его строением и электронной конфигурацией. Водород имеет один электрон в своем внешнем энергетическом уровне и стремится заполнить его, чтобы достичь более стабильной конфигурации, аналогичной гелию, имеющему два внешних электрона. В результате, водород легко участвует в химических реакциях, вступая в соединения с другими элементами.
Сравнивая электроотрицательность водорода с металлами, можно сказать, что металлы имеют более низкую электроотрицательность. Это связано с тем, что металлы имеют большее число внешних электронов и, следовательно, меньшую потребность в притяжении дополнительных электронов. В результате, металлы обычно теряют электроны при вступлении в химические реакции, образуя катионы.
Последствия различия в электроотрицательности водорода и металлов сказываются на их химических свойствах. Водород имеет большую способность образовывать связи с другими элементами, как положительными, так и отрицательными. Вместе с тем, металлы обычно образуют ионные связи с водородом, образуя металл-водородные соединения. Это позволяет использовать водород в различных процессах, таких как производство водородного газа, водородные топливные элементы и другие технические применения.
Химические последствия высокой электроотрицательности водорода
Высокая электроотрицательность водорода оказывает существенное влияние на его химические свойства и взаимодействие с другими элементами. Вода, являющаяся соединением водорода с кислородом, образует основу жизни на Земле и является важнейшим растворителем для множества химических реакций.
Ионизация воды — это процесс, при котором молекула воды расщепляется на ионы - положительно заряженный ион водорода (ион водородного катиона) и отрицательно заряженный ион гидроксила (ион гидроксильного аниона). Водородный ион может образовывать сильные химические связи с другими элементами и, таким образом, определять реакционную активность соединений, в которых он присутствует.
В высокоэлектроотрицательных веществах, таких как кислород и азот, водород образует с ними особо сильные химические связи. Наличие этих связей определяет химическую активность и неполярность раствора воды, обусловливая ее способность растворять различные вещества, такие как соли и газы.
- Высокая электроотрицательность водорода делает его превосходным агентом окислителем в химических реакциях. Он способен принимать электроны от других веществ или элементов, вызывая окисление самих себя до катионов с максимальной электроотрицательностью.
- Взаимодействие водорода с другими элементами, такими как углерод и азот, приводит к образованию сложных органических соединений, являющихся основой для образования органических молекул в биологических системах.
- Водород может образовывать сильные водородные связи с другими молекулами, такими как молекулы азота и кислорода. Эти связи обладают великим значением в живой природе, так как задают форму и структуру молекул белков и ДНК.
Таким образом, высокая электроотрицательность водорода играет ключевую роль в химических процессах, от которых зависит жизнь на Земле. Она определяет его активность в различных реакциях, взаимодействие с другими элементами и способность образовывать сложные органические соединения.
Электрические последствия высокой электроотрицательности водорода

Высокая электроотрицательность водорода имеет несколько электрических последствий, которые существенно влияют на его химические и физические свойства.
Во-первых, электроотрицательность водорода обуславливает его способность образовывать водородные связи с другими атомами. Водородные связи являются одними из наиболее сильных межмолекулярных взаимодействий. Они проявляются в ряде явлений, таких как высокая температура кипения и плавления воды, а также способность вещества к образованию сетчатых и кристаллических структур.
Во-вторых, высокая электроотрицательность водорода способствует его растворению в воде. Водород образует ионы H+ и OH-, которые взаимодействуют с другими молекулами, создавая заряженные частицы. Это явление является основой для многих реакций воды и растворов водорода.
В-третьих, электроотрицательность водорода определяет его реакционную способность. Водород способен образовывать соединения с другими элементами, особенно с электроотрицательными элементами, такими как кислород, фтор и хлор. Эти соединения обладают различными химическими и физическими свойствами и имеют широкое применение в промышленности и научных исследованиях.
В целом, электрические последствия высокой электроотрицательности водорода существенно влияют на его роль в химических реакциях и веществах, делая его одним из ключевых элементов в природе и технологии.
Влияние электроотрицательности водорода на химические реакции
Электроотрицательность водорода играет важную роль в химических реакциях. Она определяет его способность принимать или отдавать электроны, что в свою очередь влияет на взаимодействие соединений и образование новых веществ.
Высокая электроотрицательность водорода позволяет ему образовывать положительные и отрицательные ионы, вступая в реакцию с другими веществами. Например, водород может формировать положительные ионы H+, которые являются ключевыми компонентами многих кислотных реакций.
Также, водород может образовывать отрицательные ионы H-, которые являются важными веществами в реакциях с щелочами или металлами. Такие реакции могут протекать с выделением большого количества тепла или созданием пузырьков, что может вызывать интерес и использоваться в различных химических экспериментах.
Взаимодействие водорода с другими элементами также обуславливает его свойства в химических соединениях. Например, водород может образовывать сильные ковалентные связи с другими не металлами, такими как кислород или азот. Эти связи создают специфическую структуру молекулы и определяют ее свойства, например, растворимость или химическую активность.
Вопрос-ответ
В чем заключается электроотрицательность вещества?
Электроотрицательность вещества - это способность атома притягивать электроны к себе при образовании химической связи с другими атомами.
Почему электроотрицательность водорода выше, чем у металлов?
Электроотрицательность водорода выше из-за его малого размера и большой электронной плотности. Водородный атом имеет только одного электрона, который близко расположен к ядру, поэтому он сильно притягивается к ядру и проявляет высокую электроотрицательность.
Какие последствия вытекают из высокой электроотрицательности водорода?
Высокая электроотрицательность водорода влияет на его химические свойства. Водород способен образовывать сильные ковалентные связи с элементами, которые имеют низкую электроотрицательность, такими как металлы. Также высокая электроотрицательность водорода обусловливает его активность в реакциях с другими веществами.
Какая связь существует между электроотрицательностью и положением элемента в периодической системе?
Обычно электроотрицательность элементов возрастает при движении слева направо по периоду и снижается при движении сверху вниз по группе. Это связано с изменением электронной структуры, атомного радиуса и электронной плотности.
Может ли электроотрицательность вещества изменяться при его взаимодействии с другими элементами?
Да, при взаимодействии вещества с другими элементами его электроотрицательность может изменяться. Это связано с изменением расположения электронов и изменением их плотности. Например, водород может стать менее отрицательным, когда он образует ион или связь с элементами, у которых высокая электроотрицательность.
Какие элементы считаются самыми электроотрицательными в периодической системе?
Самыми электроотрицательными элементами в периодической системе являются флуор, кислород, хлор, азот и бром. Они обладают высокой электроотрицательностью и часто вступают в реакции с другими элементами, особенно с металлами.