Карбонаты щелочных металлов представляют собой класс химических соединений, основными представителями которого являются карбонаты натрия (Na2CO3) и калия (K2CO3). В своей структуре они содержат катионы металла и анион углекислоты, что делает их щелочными солями. Карбонаты щелочных металлов обладают рядом уникальных свойств, которые нашли широкое применение в различных отраслях науки и промышленности.
Одним из ключевых свойств карбонатов щелочных металлов является их растворимость в воде. При контакте с водой карбонаты диссоциируют, образуя ионы металла и гидрокарбонатные и карбонатные ионы. Такое поведение обусловлено наличием в структуре карбонатов одного или двух атомов кислорода, способных связываться с водой. Благодаря этой растворимости, карбонаты щелочных металлов широко применяются в процессах химического синтеза, очистке воды и производстве стекла.
Кроме того, карбонаты щелочных металлов обладают щелочными свойствами. В растворах они образуют гидроксиды металлов, способные реагировать с кислотами и образовывать соли. Именно благодаря этим свойствам карбонаты находят применение в процессах нейтрализации кислотных стоков и регулировании pH-уровня в различных производственных процессах.
В заключение, карбонаты щелочных металлов являются важными химическими соединениями, обладающими уникальными свойствами и имеющими широкое применение в различных отраслях науки и промышленности. Их растворимость в воде и щелочные свойства позволяют использовать их в процессах синтеза, очистки воды, регулировании pH-уровня и многих других приложениях. Безусловно, карбонаты щелочных металлов играют важную роль в современной химии и являются объектом многих исследований и разработок.
История открытия карбонатов щелочных металлов

Открытие карбонатов щелочных металлов является результатом длительных исследований и открытий в области химии. Первоначально, численное семейство карбонатов щелочных металлов было обнаружено в середине 18 века. Однако до этого момента были проведены различные эксперименты и исследования, которые послужили основой для дальнейших открытий.
Исследования в области щелочных металлов и их соединений начались с исследований французского химика Антуана Лавуазье в конце 18 века. Он придерживался теории о том, что все кислоты состоят из кислорода и некоторого основного вещества. Он открыл, что карбонаты щелочных металлов обладают свойствами щелочи и могут использоваться в различных химических реакциях.
В начале 19 века немецкий химик Хайнрих Роберт внес вклад в понимание свойств карбонатов щелочных металлов и их реакций. Он установил, что карбонаты щелочных металлов образуют гидрокарбонаты, которые обладают более кислыми свойствами. Это открытие привело к новым применениям карбонатов щелочных металлов в различных областях, включая медицину и промышленность.
С началом 20 века исследования в области карбонатов щелочных металлов стали более систематичными и основаны на более точных методах анализа. Ученые изучали свойства и структуру карбонатов, а также их взаимодействие с другими веществами. Благодаря этим исследованиям были обнаружены новые применения карбонатов щелочных металлов, включая использование их в производстве стекла, мыла, удобрений и других продуктов.
Химический состав и структура карбонатов
Карбонаты щелочных металлов являются соединениями, состоящими из аниона карбоната (CO32-) и металлического иона щелочного металла. Щелочные металлы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), обладают свойствами, способствующими образованию карбонатов.
Структура карбонатов характеризуется треугольной формой молекулы CO32-. В молекуле карбоната есть две одинаковые короткие связи между кислородом и углеродом, а также одна длинная связь между кислородом и другим углеродом. Это обусловлено применением гибридизации валентных электронных орбиталей углерода.
Образование карбонатов происходит благодаря обменной реакции между щелочным металлом и оксидом углерода (угольным диоксидом, CO2). В результате этой реакции оксид углерода реагирует с гидроксидом щелочного металла, образуя карбонат и воду.
Свойства карбонатов щелочных металлов определяются их химическим составом и уникальной структурой. Данные соединения обладают высокой щелочностью, способностью растворяться в воде и образовывать кристаллическую структуру сольватов. Карбонаты щелочных металлов широко применяются в разных отраслях, включая производство стекла, мыла, моющих средств, а также в фармацевтической и пищевой промышленности.
Физические свойства карбонатов щелочных металлов
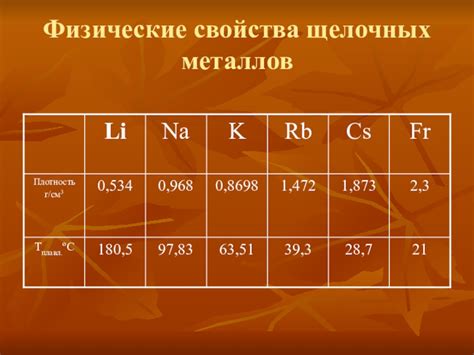
Карбонаты щелочных металлов, таких как натрий, калий, рубидий и цезий, обладают рядом физических свойств, которые делают их интересными для различных применений.
Во-первых, карбонаты щелочных металлов являются твердыми веществами с высокими температурными точками плавления. Например, карбонат натрия имеет температурную точку плавления около 855°C, а карбонат калия - около 891°C. Это позволяет использовать их в высокотемпературных процессах, таких как производство стекла и керамики.
Во-вторых, карбонаты щелочных металлов обладают высокой растворимостью в воде. Это свойство делает их полезными в качестве щелочных растворителей и отдавателей гидроксидных ионов. Например, карбонат натрия используется в процессах очистки воды и в производстве стиральных порошков.
Кроме того, карбонаты щелочных металлов обладают щелочными свойствами. Это означает, что они образуют гидроксиды в растворе и обладают щелочной реакцией при взаимодействии с кислотами. Благодаря своим щелочным свойствам, карбонаты щелочных металлов находят широкое применение в различных областях, включая пищевую промышленность, фармацевтику, производство щелочного аккумулятора и другие.
Вывод:
- Карбонаты щелочных металлов обладают высокими температурными точками плавления, что позволяет использовать их в высокотемпературных процессах.
- Они обладают высокой растворимостью в воде, что делает их полезными в процессах очистки воды и в производстве стиральных порошков.
- Карбонаты щелочных металлов образуют гидроксиды в растворе и обладают щелочной реакцией, что находит применение в различных отраслях промышленности.
Химические свойства карбонатов щелочных металлов
Карбонаты щелочных металлов - это соли, образующиеся путем химической реакции щелочного металла с углекислым газом. Они характеризуются рядом уникальных химических свойств, которые широко используются в различных областях.
Первое характерное свойство карбонатов щелочных металлов - их высокая растворимость в воде. При соприкосновении с водой карбонаты щелочных металлов претерпевают гидролиз, образуя щелочные растворы. Это делает их идеальными реагентами для регулирования pH в различных химических процессах.
Второе важное свойство карбонатов щелочных металлов - их способность давать углекислоту при взаимодействии с кислотами. Это может происходить как в растворе, так и в твердом состоянии. Карбонаты щелочных металлов являются важными источниками углекислого газа в различных процессах, таких как производство газированных напитков и космических систем.
Третье особенное свойство карбонатов щелочных металлов - их реактивность с кислородсодержащими веществами. При нагревании карбонаты щелочных металлов разлагаются, образуя оксиды. Это свойство находит широкое применение в металлургической промышленности при получении металлов из их оксидов.
Также следует отметить, что карбонаты щелочных металлов обладают свойством образования стабильных комплексов с другими соединениями, что делает их важными в качестве хелатных агентов и катализаторов в различных химических реакциях.
Применение карбонатов щелочных металлов

Карбонаты щелочных металлов - это соединения, которые широко используются в различных сферах деятельности человека. Они обладают рядом полезных свойств, таких как щелочность, растворимость в воде и возможность образования кристаллических соединений.
Одним из основных областей применения карбонатов щелочных металлов является производство стекла и стекловарение. Карбонаты щелочных металлов, такие как карбонат натрия и карбонат калия, используются в качестве компонентов стекольной массы. Они способствуют снижению температуры плавления стеклянной массы и обеспечивают ее пластичность и прозрачность.
Карбонаты щелочных металлов также активно применяются в производстве мыла и моющих средств. Они являются базовыми компонентами, обладающими моющими и отбеливающими свойствами. Карбонаты щелочных металлов помогают в удалении жиров, грязи и различных пятен.
В сельском хозяйстве карбонаты щелочных металлов применяются в качестве удобрений. Карбонат калия, например, является одним из основных удобрений для растений. Он способствует росту и развитию растений, а также улучшает плодородие почвы.
Карбонаты щелочных металлов также применяются в производстве бумаги, текстильной и легкой промышленности, а также в производстве красителей и пигментов.
В целом, карбонаты щелочных металлов имеют широкий спектр применения и являются важными соединениями для различных отраслей промышленности и сельского хозяйства.
Влияние карбонатов щелочных металлов на окружающую среду
Карбонаты щелочных металлов, такие как натрий, калий и литий, могут оказывать влияние на окружающую среду в различных аспектах. Они являются распространенными компонентами многих минералов и горных пород, которые могут иметь значительное воздействие на природу.
Одним из основных способов, которым карбонаты щелочных металлов влияют на окружающую среду, является их растворимость в воде. Когда карбонаты попадают в природные водоемы, они могут изменять ее химический состав и pH, что может негативно повлиять на растения и животных, приспособленных к определенному pH.
Кроме того, необработанные отходы, содержащие карбонаты щелочных металлов, могут быть выброшены на землю или в воду в результате промышленных процессов или человеческой деятельности. Это может привести к загрязнению почвы и водных ресурсов, а также негативно сказаться на биологическом разнообразии и жизнеспособности организмов, которые полагаются на чистую природную среду.
Карбонаты щелочных металлов также могут играть роль в глобальном изменении климата. Воздействуя на состав атмосферы, они могут влиять на рефлексию солнечной радиации и тем самым влиять на потепление или охлаждение планеты. Кроме того, карбонаты могут быть продуктом горения и нагревания и, таким образом, выводить вредные газы в атмосферу, что способствует парниковому эффекту.
В целом, карбонаты щелочных металлов имеют сложное влияние на окружающую среду, и необходимо принимать меры для контроля и уменьшения их негативного воздействия. Это может включать в себя эффективную обработку и очистку промышленных отходов, а также сокращение использования и выбросов карбонатов в природную среду.
Технологическое производство карбонатов щелочных металлов
Производство карбонатов щелочных металлов является важной и широко используемой технологической отраслью. Карбонаты щелочных металлов, такие как карбонат натрия (Na2CO3) и карбонат калия (K2CO3), являются основными источниками щелочных металлов в промышленности.
Процесс производства карбонатов щелочных металлов включает в себя несколько этапов. Вначале выполняется добыча сырья, которое может быть натуральным или синтетическим. Затем сырье подвергается обработке, в результате которой происходит щелочное выщелачивание.
Полученная после выщелачивания щелочная руда подвергается фильтрации и отстаиванию, чтобы удалить остаточные твердые частицы. Далее полученный раствор проходит процесс очистки с помощью электролиза или химической обработки. В конце производства осуществляется обезвоживание полученной в результате реакции соляной кислоты и карбидной квашением карбоната щелочного металла.
Использование карбонатов щелочных металлов в промышленности очень широко. Например, карбонат натрия используется в производстве стекла, губок и моющих средств. Карбонат калия применяется в химической, пищевой и медицинской промышленности.
Технология производства карбонатов щелочных металлов постепенно усовершенствуется и совершенствуется, что позволяет получать более качественные продукты. Это способствует развитию промышленности и удовлетворяет растущий спрос на щелочные металлы в различных отраслях экономики.
Перспективы развития применения карбонатов щелочных металлов
Карбонаты щелочных металлов – это соединения, обладающие широким спектром полезных свойств и применяемые в различных отраслях промышленности и науки. Они представляют собой соли щелочных металлов и угольной кислоты, объединяющие в себе свойства как металлов, так и кислот. Это делает карбонаты щелочных металлов уникальными и востребованными во многих областях деятельности.
Одной из перспектив развития применения карбонатов щелочных металлов является их использование в строительной индустрии. Карбонаты щелочных металлов могут использоваться в качестве добавок в строительные материалы, такие как цемент. Они улучшают физико-химические свойства материала, повышают его прочность и стойкость к разрушению. Кроме того, карбонаты щелочных металлов обладают способностью поглощать углекислый газ, что является актуальным вопросом при поиске экологически чистых и энергоэффективных строительных решений.
Еще одним перспективным направлением применения карбонатов щелочных металлов является область электрохимии и энергетики. Карбонаты щелочных металлов могут быть использованы как электролиты в различных типах аккумуляторов и батарей. Они способны обеспечить высокую производительность и эффективность энергетических устройств, а также улучшить их безопасность и долговечность. Кроме того, карбонаты щелочных металлов могут быть применимы в процессах хранения и передачи электроэнергии, что делает их еще более перспективными в контексте развития энергетической инфраструктуры.
Также карбонаты щелочных металлов имеют широкий спектр применения в пищевой промышленности. Они используются в качестве регуляторов кислотности и стабилизаторов при производстве консервов, молочных продуктов, сладостей и других пищевых продуктов. Карбонаты щелочных металлов способны обеспечить необходимый уровень pH, а также улучшить хранение и структуру продуктов.
Наконец, карбонаты щелочных металлов находят применение в медицине и фармакологии. Они используются в производстве препаратов, особенно витаминных и минеральных комплексов, а также в качестве компонентов в зубных пастах и других гигиенических средствах. Карбонаты щелочных металлов обладают антацидным и антисептическим эффектом, способствуют заживлению, а также укреплению костей и зубов.
Вопрос-ответ
Какие свойства имеют карбонаты щелочных металлов?
Карбонаты щелочных металлов обладают рядом характерных свойств. Во-первых, они растворяются в воде, образуя растворы, щелочные по своей природе. Во-вторых, они хорошо реагируют с кислотами, образуя соли и выделяя диоксид углерода. Также карбонаты щелочных металлов обладают щелочной реакцией и высокой растворимостью в воде.
Какие щелочные металлы входят в группу карбонатов?
В группу карбонатов входят щелочные металлы: литий, натрий, калий, рубидий и цезий. Карбонаты этих металлов широко добываются и применяются в различных отраслях промышленности и научных исследованиях.
Каковы применения карбонатов щелочных металлов?
Карбонаты щелочных металлов имеют широкие применения в различных сферах. Например, карбонат натрия (сода) используется в пищевой промышленности, для очистки воды, производства стекла и мыла. Карбонат калия применяют в производстве удобрений, пищевых добавок и аккумуляторов. Карбонаты щелочных металлов также используются в качестве термических стабилизаторов, коагулянтов, антисептиков и прочих химических соединений.
В чем отличие карбонатов щелочных металлов от других карбонатов?
Отличие карбонатов щелочных металлов от других карбонатов заключается в том, что они образуют щелочные растворы, реагируют с кислотами и выделяют диоксид углерода. Кроме того, карбонаты щелочных металлов обладают высокой растворимостью в воде.
Каковы основные методы получения карбонатов щелочных металлов?
Основные методы получения карбонатов щелочных металлов - это нейтрализация щелочными растворами кислот или осаждение солей при растворении соответствующего оксида или гидроксида в углекислом газе. Также карбонаты щелочных металлов могут быть получены при реакции металлов с углекислым газом.
