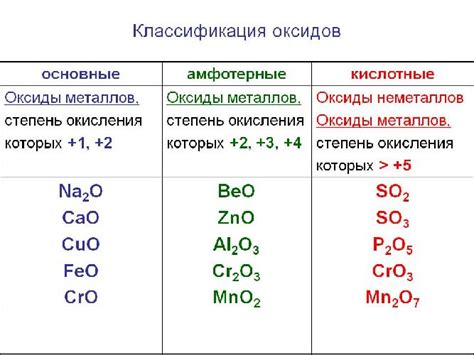
Реакция металлических оксидов с водородом является одной из важных химических реакций, которая происходит при высоких температурах. Оксиды металлов – это соединения металлов с кислородом, которые обладают различными свойствами и играют важную роль в различных процессах.
При контакте оксидов металлов с водородом происходит реакция, в результате которой образуются соединения, содержащие водород. Изначально металлический оксид взаимодействует с водородом, образуя металлический гидроксид и выделяя молекулы воды. Данная реакция основывается на принципе обратимости и может происходить в обоих направлениях, в зависимости от условий.
Примером такой реакции может служить реакция оксида натрия (Na2O) с водородом. При нагревании оксид натрия с водородом образуется гидроксид натрия (NaOH) и молекулы воды (H2O). Реакция протекает по следующему уравнению: Na2O + H2 → 2NaOH + H2O. В данном случае, оксид натрия реагирует с водородом, образуя гидроксид натрия и выделяя молекулы воды.
Реакция оксидов металлов с водородом находит применение в различных отраслях промышленности и научных исследованиях. Это позволяет получать различные соединения водорода, которые могут быть использованы в качестве топлива, а также в процессах порошковой металлургии. Более того, реакция оксидов металлов с водородом является важным компонентом водородного круговорота, который рассматривается в качестве одного из перспективных источников возобновляемой энергии.
Оксиды металлов: определение и свойства
Оксиды металлов - это неорганические соединения, состоящие из металла и кислорода. Эти соединения обладают различными свойствами, включая химическую активность и степень растворимости.
Оксиды металлов обычно имеют кристаллическую структуру и могут быть как ионными, так и ковалентными соединениями. Их цвет может варьировать в зависимости от металла - от белого и безцветного до различных оттенков.
Некоторые оксиды металлов обладают свойствами катализаторов, то есть способствуют ускорению химических реакций без изменения самих оксидов. Другие оксиды металлов могут быть растворимыми в воде, образуя щелочные растворы или оксиды, которые образуют кислотные растворы.
Свойства оксидов металлов также варьируются в зависимости от окислительных состояний металлов. Оксиды низкого окислительного состояния обычно являются нерастворимыми в воде и химически инертными, тогда как оксиды высокого окислительного состояния обычно обладают большей химической активностью и могут реагировать с другими веществами.
Важным свойством некоторых оксидов металлов является их способность взаимодействовать с водородом. При реакции оксидов металлов с водородом обычно выделяется вода, а металл возвращается в свою исходную форму. Реакции этих оксидов с водородом являются важным процессом в различных технологических отраслях, включая производство металлов и природного газа.
Водород как реагент: химические особенности
Водород является химическим элементом с атомным номером 1. Он обладает низкой плотностью, малой молекулярной массой и высокой электроотрицательностью. Водород является очень реакционным и может участвовать во множестве химических реакций, в том числе реагировать с оксидами металлов.
Одной из главных химических особенностей водорода является его способность проявлять окислительные и восстановительные свойства. Он может реагировать с веществами, отдавая или принимая электроны. В реакции с оксидами металлов водород может выступать в качестве восстановителя, то есть принимать электроны и уменьшать окислительное состояние металла.
Реакция оксидов металлов с водородом может проходить при различных условиях: при нагревании, в присутствии катализаторов или с использованием электрической энергии. Реакция обычно протекает с образованием воды и обратима, то есть водород можно получить обратно, обработав воду электрическим током.
Реакция оксидов металлов с водородом: механизм процесса
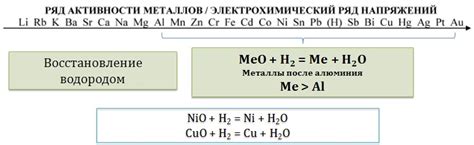
Реакция оксидов металлов с водородом представляет собой важный химический процесс, который основан на взаимодействии оксида металла с молекулами водорода. Данная реакция является редукционной, так как оксид металла в результате реакции теряет кислород.
Механизм процесса включает несколько этапов. Первоначально молекулы водорода проникают в оксид металла, проникают в его структуру и вступают в контакт с активными центрами металла. Затем происходит процесс диссоциации молекул водорода на атомы, которые в свою очередь окисляются оксидом металла. В результате образуется молекулярный водород и металл в его восстановленном состоянии.
Оксиды металлов, как правило, обладают высокой активностью в реакции с водородом. Это связано с их способностью к образованию типичной ионной связи с кислородом, что делает оксиды хорошими окислителями в данной реакции. Некоторые из наиболее активных оксидов в реакции с водородом включают оксиды металлов таких как железо, медь, цинк, алюминий и другие.
Классификация реакций металлических оксидов с водородом
Реакции металлических оксидов с водородом можно классифицировать по типу оксида и типу реакции, которая происходит.
Одним из типов реакций является восстановительная реакция, при которой металлический оксид восстанавливается до металла, а водород окисляется до воды. Такие реакции обычно протекают в присутствии катализатора и при повышенной температуре. Примером такой реакции может служить реакция медного оксида с водородом:
- CuO + H2 -> Cu + H2O
Другим типом реакций является реакция ацидообразующая, при которой образуется соответствующая кислота. В таких реакциях обычно участвуют оксиды нескольких видов металлов. Например, реакция оксида железа (III) с водородом может привести к образованию воды и кислоты:
- Fe2O3 + 3H2 -> 2Fe + 3H2O
Также можно выделить реакции, при которых образуется металлический гидрид. Гидриды часто применяются в качестве промежуточных или конечных продуктов в химических процессах. Например, реакция оксида алюминия с водородом может приводить к образованию гидрида алюминия:
- Al2O3 + 3H2 -> 2AlH3
Таким образом, классификация реакций металлических оксидов с водородом позволяет детально изучить различные типы и механизмы этих реакций, что является важным для понимания химических процессов и их применения в различных областях науки и промышленности.
Примеры реакций оксидов металлов с водородом
Реакция оксидов металлов с водородом является отличным примером реакции оксидации-восстановления. В результате этой реакции металлический оксид, содержащий металл в положительной степени окисления, взаимодействует с молекулярным водородом, при этом металл восстанавливается до нулевой степени окисления, а водород окисляется до протонов.
Одним из примеров такой реакции является реакция оксида железа (III) с водородом. Эта реакция представлена уравнением:
Fe2O3 + 3H2 = 2Fe + 3H2O
В результате этой реакции железо (III) окисляется до железа (II), а водород окисляется до воды. Реакция протекает с выделением тепла и света, поэтому в промышленных масштабах она используется для получения металлического железа.
Другим примером реакции оксида металла с водородом является реакция оксида алюминия с водородом. Эта реакция может протекать при повышенных температурах и представлена следующим уравнением:
2Al2O3 + 3H2 = 4Al + 3H2O
В результате этой реакции алюминий окисляется до иона алюминия, а водород окисляется до воды. Реакция также сопровождается выделением тепла.
Приведенные примеры демонстрируют важность реакции оксидов металлов с водородом и ее применение в различных областях науки и промышленности.
Практическое применение реакций оксидов металлов с водородом
Реакции оксидов металлов с водородом имеют широкое практическое применение в различных отраслях науки и промышленности. Оксиды металлов, такие как оксид алюминия, оксид железа и оксид меди, могут использоваться в качестве катализаторов для процесса производства аммиака. Реакция оксида железа с водородом играет важную роль в гидрогенации и восстановлении органических соединений.
Кроме того, реакции оксидов металлов с водородом используются в производстве металлов и сплавов. Например, реакция оксида алюминия с водородом приводит к образованию металла алюминия. Оксиды металлов также могут служить источником водорода для использования в газовых клетках и водородных топливных элементах.
Оксиды металлов, прошедшие реакцию с водородом, также используются в процессе синтеза различных органических соединений. Например, реакция оксида меди с водородом может привести к получению метанола, который является одним из наиболее важных химических сырьевых материалов.
Вопрос-ответ
Какие оксиды металлов могут реагировать с водородом?
Реагировать с водородом могут оксиды металлов, которые обладают низкой электроотрицательностью и железом, никелем, цинком, магнием и алюминием входят в их число.
Почему оксиды металлов реагируют с водородом?
Оксиды металлов реагируют с водородом, так как в процессе реакции происходит образование воды, а оксид металла превращается в соответствующий металл и выделяется в виде металлического гидрида.
Какие примеры реакции оксидов металлов с водородом можно привести?
Примерами реакции оксидов металлов с водородом можно назвать реакцию меди(II) оксида с водородом, в результате которой образуется медь и вода; реакцию алюминия оксида с водородом, в результате которой образуется алюминий и вода; реакцию цинка оксида с водородом, в результате которой образуется цинк и вода.
Какие условия необходимы для реакции оксидов металлов с водородом?
Для реакции оксидов металлов с водородом необходимо наличие высокой температуры, превышающей температуру плавления конкретного оксида, а также снижение давления в системе.
Какие свойства обладает образовавшийся гидрид в результате реакции оксидов металлов с водородом?
Образовавшийся гидрид обычно обладает металлическими свойствами, такими как хорошая электропроводность и пластичность.
В чем применение реакции оксидов металлов с водородом?
Реакция оксидов металлов с водородом находит применение в различных промышленных процессах, таких как производство металлических гидридов и водородного привода.
Может ли реакция оксидов металлов с водородом протекать самопроизвольно?
Реакция оксидов металлов с водородом не протекает самопроизвольно, она требует внешнего нагрева и снижения давления для активации.
