Электроны являются основными частицами, определяющими химические свойства атомов. Количество электронов в атоме зависит от его атомного номера, определяющего его положение в периодической таблице элементов Менделеева. Отдающие электроны - это электроны, участвующие в химических реакциях и образующие ее электронную конфигурацию.
Металлы - это элементы, обладающие хорошей проводимостью электричества и теплоотдачей. Они обычно отдают электроны при химических реакциях. Число отдающих электронов в атоме металла можно определить из его электронной конфигурации и положения в периодической таблице.
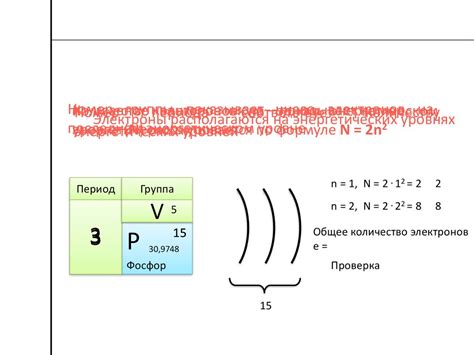
Периодическая таблица элементов Менделеева упорядочивает элементы по возрастанию атомного номера. Каждый элемент имеет свою уникальную электронную конфигурацию, которая показывает, сколько электронов находится на каждом энергетическом уровне вокруг ядра атома.
Наиболее простой способ определить число отдающих электронов атома металла - это посмотреть на его группу в периодической таблице. Металлы находятся слева от диагональной черты, которая проходит по элементам бора (B), алюминия (Al), силиция (Si), германия (Ge), астатина (As), селена (Se), теллура (Te) и полония (Po). Количество отдающих электронов обычно равно номеру группы, в которой находится металл. Например, элемент из 1 группы будет отдавать 1 электрон, а элемент из 2 группы - 2 электрона.
Способы определения числа электронов в атомах металлов
Для определения числа электронов в атомах металлов существуют различные методы исследования. Один из них основан на изучении электронной структуры атома и его электронной конфигурации.
У каждого атома металла имеются энергетические уровни, на которых находятся электроны. Они заполняют эти уровни согласно правилам, известным из квантовой механики. Атомы металлов обычно имеют несколько электронов в своей внешней оболочке, что делает их хорошими проводниками электричества. Определение числа электронов в атоме можно осуществить, например, с помощью рентгеновской спектроскопии или электронной спектроскопии.
С помощью рентгеновской спектроскопии можно исследовать атомы металлов, используя рентгеновское излучение. При этом происходит испускание или поглощение рентгеновских квантов, что связано с переходом электронов с одного энергетического уровня на другой. Из анализа рентгеновского спектра можно определить характерные значения энергии перехода, что позволяет определить число электронов в атоме.
Электронная спектроскопия основана на измерении энергии и интенсивности испускаемого или поглощаемого света при возбуждении атомов металла. Атомы металла могут испускать свет, если их электроны переходят с одного энергетического уровня на другой ниже энергетического. С помощью специальных приборов можно измерить энергию испускаемого света и определить характерные значения, которые связаны с энергетической структурой атомов металла и числом электронов в их оболочках.
Методы определения числа электронов в атомах металлов позволяют более глубоко изучить их свойства и поведение в различных условиях. Это имеет практическое значение при создании новых материалов, разработке технологий и прогнозировании их свойств.
Методы анализа электронной структуры
Анализ электронной структуры атомов металлов является важным шагом для понимания их химических свойств и реакций. Существуют различные методы, которые позволяют определить число отдающих электронов атома металла.
Один из таких методов - рентгеновская структурная дифрактометрия. Этот метод основан на изучении дифракции рентгеновских лучей в кристаллических структурах металлов. Анализ распределения электронной плотности в кристаллической решетке позволяет определить число отдающих электронов атома металла.
Другой метод - фотоэлектронная спектроскопия. В этом методе изучается излучение электронов, вылетающих из поверхности материала под действием фотонов. Анализ энергий и интенсивностей вылетающих электронов позволяет получить информацию о электронной структуре атомов металла и определить число отдающих электронов.
Еще один метод - магнитная крупносеточная структура. Он основан на изучении магнитных свойств и электронной структуры вещества при помощи магнитной дифракции. Измерение магнитной структуры позволяет определить число отдающих электронов атома металла.
Также используются расчетные методы на основе квантово-химических моделей. При помощи компьютерных симуляций и квантово-химических расчетов можно получить информацию о электронной структуре атома металла и определить число отдающих электронов без необходимости проведения экспериментов.
Все эти методы позволяют уточнить электронную структуру атомов металла и получить информацию о числе отдающих электронов. Это важные данные для понимания свойств и реакций металлов и их использования в различных областях науки и технологий.
Изучение химических свойств

Изучение химических свойств является важной частью химических наук, которая направлена на изучение взаимодействия различных веществ, их свойств и состава. Особое внимание уделяется изучению реакций вещества с другими веществами, которые могут приводить к изменению химической структуры и образованию новых соединений.
В одном из направлений химии - неорганической химии - изучаются химические свойства неорганических веществ, таких как кислоты, основания, соли, металлы и другие соединения. Важной частью исследования является анализ свойств металлов и их соединений, включая взаимодействие металлов с другими веществами.
Одним из важных параметров для изучения свойств металлов является число отдающих электронов атома металла. Число отдающих электронов определяет химическую активность металла и его способность образовывать положительные ионы. Чем больше число отдающих электронов, тем более активным будет металл.
Для определения числа отдающих электронов атома металла можно использовать периодическую таблицу элементов. В ней указана группа элемента, которая определяет число отдающих электронов. Например, металлы в группе 1 отдают 1 электрон, металлы в группе 2 - 2 электрона, а примесные металлы могут отдавать разное число электронов в зависимости от своей химической активности.
Изучение химических свойств металлов и других веществ позволяет лучше понять их взаимодействие с окружающей средой и использовать их в различных приложениях, таких как производство материалов, лекарств и технических устройств. Благодаря этому знаниям можно разрабатывать новые способы синтеза соединений и улучшать существующие процессы в химической промышленности.
Спектроскопический анализ
Спектроскопический анализ – это метод исследования вещества, основанный на изучении его спектральных характеристик. Спектральные характеристики могут быть получены с помощью спектроскопических приборов, которые разбивают свет на отдельные компоненты и измеряют их интенсивность.
В контексте определения числа отдающих электронов атома металла, спектроскопический анализ может использоваться для изучения электронных переходов в атомах данным металла. Путем анализа спектров поглощения и спектров испускания можно определить уровни энергии, на которых находятся электроны, а также их переходы между этими уровнями.
При спектроскопическом анализе используются различные типы спектроскопии, включая атомно-эмиссионную спектроскопию (АЭС) и атомно-абсорбционную спектроскопию (ААС). В АЭС исследуется спектр испускания атомов металла, когда они возбуждаются и переходят на более высокий энергетический уровень. В ААС изучается спектр поглощения, когда свет определенной частоты поглощается атомами металла.
Спектроскопический анализ позволяет установить связь между структурой атома металла и его спектральными характеристиками. Например, количество отдающих электронов в атоме металла может быть определено по числу спектральных линий, соответствующих электронным переходам, связанным с отдачей электрона.
Таким образом, спектроскопический анализ является мощным инструментом для изучения атомных и молекулярных структур вещества и может быть применен для определения различных характеристик атомов металла, в том числе количества отдающих электронов.
Ионизационные потенциалы элементов

Ионизационный потенциал - это энергия, необходимая для удаления одного электрона из атома. Чтобы определить число отдающих электронов атома металла, необходимо знать значения ионизационных потенциалов для соответствующего элемента.
Ионизационные потенциалы элементов различны и зависят от различных факторов, таких как заряд ядра атома, радиус атома, электронная конфигурация и другие. Чем больше значение ионизационного потенциала, тем больше энергии необходимо для удаления электрона, а значит, меньше вероятность того, что атом будет его отдавать.
Относительные значения ионизационных потенциалов можно найти в специальных таблицах, которые содержат данные для всех известных элементов. В таблицах приводятся значения ионизационных потенциалов первых, вторых, третьих и т. д. электронов. Также в таблицах можно найти средние значения ионизационных потенциалов для различных групп элементов.
Наибольшие ионизационные потенциалы обычно имеют элементы, которые расположены в правой части периодической системы, например, гелий, неон, аргон и другие инертные газы. Они имеют полностью заполненные электронные оболочки и трудно отдают свои электроны. С другой стороны, элементы металлических групп имеют более низкие ионизационные потенциалы и более легко отдают свои электроны.
Таким образом, зная значения ионизационных потенциалов элементов, можно определить, какие атомы металлов склонны отдавать электроны и в каком количестве. Это знание важно при изучении химических реакций, особенно в реакциях связывания и образования ионов.
Использование рентгеновской спектроскопии
Рентгеновская спектроскопия является одним из основных методов исследования атомной структуры вещества. Она позволяет определить число отдающих электронов в атоме металла.
Для проведения рентгеновской спектроскопии используется рентгеновский излучатель, который облучает образец вещества. При взаимодействии рентгеновского излучения с атомами металла происходит рассеяние и поглощение фотонов, что ведёт к изменению энергии и направления движения электронов. Используя специальные детекторы, можно получить спектр рассеянных и поглощенных фотонов.
Анализ рентгеновского спектра позволяет определить энергетическую структуру атома металла и, следовательно, число отдающих электронов. Качественный анализ спектра позволяет определить химический элемент, к которому относится образец вещества. Количественный анализ спектра позволяет определить концентрацию атомов металла в образце.
Рентгеновская спектроскопия широко применяется в материаловедении, химии и физике. Она позволяет исследовать свойства различных материалов, идентифицировать химические соединения, определять структуру кристаллов и поверхностных слоев, а также изучать поведение атомов и электронов в экстремальных условиях.
Вопрос-ответ
Как определить число отдающих электронов атома металла?
Чтобы определить число отдающих электронов атома металла, вы можете использовать его электронную конфигурацию. В электронной конфигурации атома металла, электроны размещаются в различных энергетических уровнях и подуровнях. Отдающие электроны находятся на самом высоком энергетическом уровне и последнем подуровне. Чтобы определить число отдающих электронов, посмотрите на количество электронов на самом высоком энергетическом уровне и подуровне. Например, если атом металла имеет электронную конфигурацию 4s2 3d10 4p6, это означает, что он отдаёт два электрона.
Как можно определить число отдающих электронов без электронной конфигурации?
Если у вас нет электронной конфигурации атома металла, вы можете использовать его положение в периодической таблице элементов для определения числа отдающих электронов. Атомы металлов, обычно отдают внешние электроны и образуют положительные ионы. Число отдающих электронов для металлов равно числу электронов во внешней оболочке. Например, металлы в первой группе (алкалии) имеют одного отдающего электрона, металлы во второй группе имеют два отдающих электрона, и так далее.
Какой метод наиболее точно позволяет определить число отдающих электронов атома металла?
Наиболее точным методом для определения числа отдающих электронов атома металла является использование его электронной конфигурации. Электронная конфигурация показывает точное расположение электронов в различных энергетических уровнях и подуровнях атома металла. Это позволяет определить число отдающих электронов на самом высоком энергетическом уровне и подуровне. Таким образом, использование электронной конфигурации является наиболее точным способом определения числа отдающих электронов.


