Нитраты являются типом химических соединений, содержащих анион NO3-. Разложение нитратов может привести к образованию различных продуктов, в зависимости от основного металла, составляющего нитрат. Однако, в случае разложения нитрата, содержащего калий (K), образуется металл с формулой KNO3.
Калийный нитрат (KNO3), также известный как соляра петербургская и селитра, одно из наиболее известных и широко используемых соединений во многих отраслях промышленности и сельского хозяйства. Этот нитрат широко используется в производстве удобрений, пиротехники, пищевых добавок и многих других продуктов.
При разложении калийного нитрата (KNO3) под действием тепла или восстановителя, образуется металл с ионной формулой KNO3.
Разложение калийного нитрата может произойти при повышенной температуре, например, путем нагревания его до определенной точки плавления. В результате получается металлическое соединение, которое можно использовать в различных отраслях, включая производство пигментов, стекла и взрывчатых веществ.
Таким образом, разложение калийного нитрата (KNO3) является важным процессом для получения металла с такой формулой.
Разложение нитрата калия
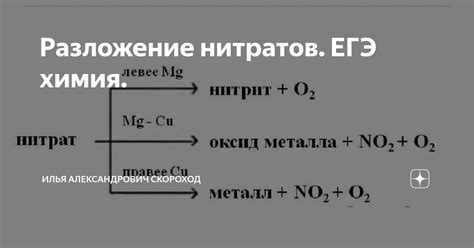
Нитрат калия (KNO3) - это белая кристаллическая соль, которая широко используется в различных отраслях промышленности и сельского хозяйства. При разложении нитрата калия выделяются существенные изменения, которые могут быть полезными в различных процессах и экспериментах.
Температура является основным фактором, определяющим результаты разложения нитрата калия. При нагревании нитрата калия до температуры, превышающей 400°С, происходит его термическое разложение. В результате разложения образуются твердое вещество, оксид калия (K2O), и газообразное соединение, оксид азота (NO). Данный процесс является эндотермическим, т.е. требует поглощения тепла.
Количество выделяющегося газообразного оксида азота (NO) при разложении нитрата калия зависит от использованных условий и конкретной температуры. Образующийся реакционный газ NO обладает характерным красным цветом и может быть использован в различных аналитических и исследовательских целях.
Разложение нитрата калия может быть ускорено добавлением катализатора, такого как медь или марганец. Как правило, такая реакция происходит быстрее и более эффективно при повышенной температуре. Образование оксида калия (K2O) и оксида азота (NO) является результатом химического разложения нитрата калия при достаточно высоких температурах.
Разложение нитрата калия является важным процессом, используемым в химической промышленности, сельском хозяйстве и научных исследованиях. Оно позволяет получить ценные продукты, такие как оксид калия (K2O), и использовать образующийся газ (оксид азота) для различных целей. Реакции разложения нитрата калия широко изучены и находят применение в различных научных и промышленных областях.
Как металл получают из KNO3?
KNO3, или калиевый нитрат, является химическим соединением, которое можно использовать для получения различных металлов. В процессе разложения KNO3 получают металл калий.
Для получения металла калия из KNO3 необходимо провести процесс электролиза. В электролизе проводятся электролитические реакции, в результате которых происходит разложение соединения и получение искомого продукта.
Сначала KNO3 должен быть переведен в расплавленное состояние, чтобы проводить электролиз. Затем его помещают в специальную электролитическую ячейку с двумя электродами. В ячейке проводят электрический ток, и при этом происходит реакция разложения KNO3.
В результате процесса электролиза на аноде образуются кислород и азот, а на катоде выделяется металл калий. Металл калий образует сталкивающиеся частицы, которые могут быть собраны, очищены и использованы для различных промышленных целей.
Важно отметить, что процесс получения металла калия из KNO3 требует специального оборудования и навыков в химической лаборатории. Без должной подготовки и знаний реакции могут быть опасными и привести к несчастному случаю.
Какой металл получается при разложении нитрата калия?

При разложении нитрата калия образуется металл - калий (K). Нитрат калия (KNO3) является солью, содержащей катионы калия (K+) и анионы нитрата (NO3-). При нагревании нитрат калия разлагается на окислитель (кислород) и соответствующий металл, в данном случае - калий.
Калий является щелочным металлом и обладает серебристо-белым цветом. Он имеет низкую плотность и мягкость, легко режется ножом. Калий очень реактивен и быстро окисляется на воздухе, поэтому хранится в масле или парафине. Он также реагирует со многими веществами, в том числе с водой, образуя гидроксид калия (KOH) и выделяя водород.
Калий широко применяется в промышленности, в том числе в производстве удобрений, стекла, мыла и жидкостей для охлаждения. Он также используется в лабораторных исследованиях и экспериментах, например, для получения других соединений калия или в качестве стандарта для проведения реакций.
Вопрос-ответ
Какой металл получается при разложении нитрата KNO3?
При разложении нитрата KNO3 получается металл калий (K).
Какой нитрат нужно разложить, чтобы получить металл KNO3?
Металл KNO3 получается при разложении нитрата калия (KNO3).
Какой металл получается из нитрата калия (KNO3)?
Из нитрата калия (KNO3) получается металл калий (K).
Какой металл образуется при разложении нитрата калия (KNO3)?
При разложении нитрата калия (KNO3) образуется металл калий (K).
Каким металлом является KNO3?
KNO3 - это нитрат калия (KNO3), а не металл. При разложении нитрата калия (KNO3) образуется металл калий (K).