Щелочные металлы – это элементы химической группы 1 периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов и обладают характерными особенностями, которые делают их важными объектами изучения в химии. Основные свойства щелочных металлов включают низкую плотность, мягкость, низкую точку плавления и высокую активность в реакциях.
Решение задач по теме "Щелочные металлы" для 9 класса позволяет углубить знания о свойствах и химическом поведении этих элементов. В ходе решения задач учащиеся будут применять полученные теоретические знания, анализировать условия задач и применять соответствующие законы и правила химии. Решение задач поможет учащимся развить логическое мышление, навыки работы с информацией и применение алгоритмов решения задач.
Примеры задач по теме "Щелочные металлы" для 9 класса могут включать расчеты по массовой доле элемента в соединении, определение количества вещества щелочного металла в реакциях, анализ условий реакций с участием щелочных металлов и другие задачи, связанные с химическим поведением данных элементов.
Учебный материал по решению задач по теме "Щелочные металлы"

Тема "Щелочные металлы" является важным разделом химии, требующим особого внимания при изучении. Решение задач по данной теме помогает углубить знания об особенностях щелочных металлов и их применении в различных сферах.
Для успешного решения задач по щелочным металлам необходимо знать их основные химические свойства, такие как низкая электроотрицательность, высокая активность и способность реагировать с водой. Одним из ключевых моментов при решении задач является правильное составление ионных уравнений реакций, которые возникают при взаимодействии щелочных металлов с другими веществами.
При решении задач по щелочным металлам активно используются таблицы стандартных электродных потенциалов, которые позволяют определить возможность протекания реакций и их направление. Необходимость учета концентраций ионов в растворах также является важным аспектом решения задач по этой теме.
Решение задач по щелочным металлам требует аналитических навыков и умения аргументировать свои ответы на основе знаний об химических свойствах этих металлов. Важно уметь применять теоретические знания на практике и использовать их для понимания и объяснения физических и химических явлений.
Определение щелочных металлов
Щелочные металлы - это группа элементов, начальные (первые) элементы пятой группы периодической системы химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы характеризуются высокой химической активностью и способностью образовывать ионные соединения в щелочных растворах.
Определение щелочных металлов основано на реакциях, которые они образуют вещества, взаимодействующими с водой. Щелочные металлы реагируют с водой, выделяя гидроген и образуя щелочные растворы, в состав которых входит гидроксид щелочного металла.
Например, литий реагирует с водой с образованием гидроксида лития и выделением водорода:
2Li + 2H2O → 2LiOH + H2
Аналогичным образом, натрий реагирует с водой и образует гидроксид натрия и водород:
2Na + 2H2O → 2NaOH + H2
Таким образом, реакция щелочных металлов с водой может быть использована для определения их наличия и идентификации.
Определение принадлежности элемента к группе щелочных металлов также может осуществляться с помощью расчета его электроотрицательности, так как щелочные металлы обладают относительно низкими значениями электроотрицательности.
Свойства и химическая активность щелочных металлов
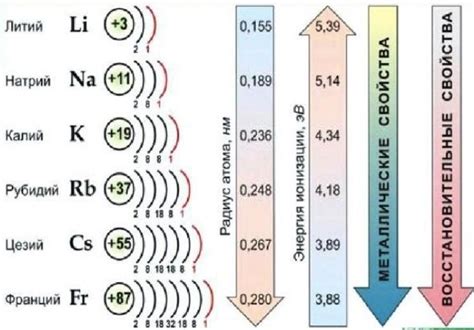
Щелочные металлы – это элементы, входящие в первую группу периодической системы. Они включают литий, натрий, калий, рубидий, цезий и франций. У них свойства, отличающие их от других металлов, и эти свойства делают их очень активными химическими элементами.
Щелочные металлы обладают химической активностью, связанной с их электронной конфигурацией. У них внешний электронный слой состоит из одного электрона, что делает их очень реактивными. Они легко отдают этот электрон при контакте с другими элементами, таким образом, проявляя свою активность.
Щелочные металлы обладают металлическим блеском и хорошей теплопроводностью. У них низкая плотность, что делает их легкими. Они также имеют низкую температуру плавления и кипения, что делает их состоянием при комнатной температуре. Они реагируют с водой, выделяя водород и образуя щелочные растворы. Реакция щелочных металлов с водой является очень экзотермической и может быть взрывоопасной, поэтому необходима осторожность при работе с этими металлами.
Щелочные металлы имеют низкую электроотрицательность и сильно реагируют с кислородом, образуя оксиды. Эти оксиды растворяются в воде, образуя щелочные растворы. Щелочные металлы также реагируют с халогенами, образуя соли. Эта реакция также является очень экзотермической и иногда может быть взрывоопасной.
Решение задач на расчет массы вещества
При решении задач на расчет массы вещества необходимо учитывать, что масса вещества зависит от его плотности и объема. Для решения задачи нужно знать плотность вещества и объем, который занимает данная масса.
Если известна плотность вещества и его объем, то массу можно рассчитать по формуле: масса = плотность * объем. Например, при решении задачи на расчет массы металла нужно знать плотность данного металла и его объем. Подставив значения в формулу, получим значение массы металла.
Если известна масса вещества и плотность, то объем v можно рассчитать по формуле: объем = масса / плотность. Например, при решении задачи на расчет объема жидкости нужно знать массу данной жидкости и ее плотность. Подставив значения в формулу, получим значение объема жидкости.
При решении задач на расчет массы вещества помимо плотности и объема может быть задана также концентрация вещества или его процентное содержание в растворе. В этом случае можно воспользоваться формулой, где процент содержания вещества указывается в виде десятичной дроби. Например, массу вещества можно рассчитать по формуле: масса = объем * плотность * концентрация.
Таким образом, при решении задач на расчет массы вещества необходимо знать плотность, объем, концентрацию или процентное содержание вещества, а также использовать соответствующие формулы для расчета массы или объема.
Решение задач по соотношению количеств вещества

Соотношение количеств вещества – это основной закон химии, который гласит, что в превращении веществ количество вещества сохраняется. Применяется этот закон и при решении задач, связанных с расчетами в химических реакциях.
Для решения задач по соотношению количеств вещества необходимо знать молярные массы веществ, а также химические уравнения реакций. Первым шагом в решении задачи является определение стехиометрического коэффициента вещества, относительно которого ищется количество вещества. Далее можно применить формулу, связывающую количество вещества с массой или объемом.
Для облегчения расчетов можно использовать таблицу со стехиометрическими коэффициентами, которая позволяет определить соотношение между веществами в химической реакции. Также удобно использовать уравнение Клапейрона для расчета количества вещества при известном давлении, объеме и температуре.
Решение задач по соотношению количеств вещества требует внимательности и точности в расчетах. Необходимо правильно интерпретировать условие задачи, учитывать все известные данные и применять соответствующие формулы. При этом важно не забывать о молярной массе и стехиометрических коэффициентах, чтобы получить правильный ответ.
Вопрос-ответ
Что такое щелочные металлы?
Щелочные металлы - это группа химических элементов периодической системы, которые входят в первую группу и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства имеют щелочные металлы?
Щелочные металлы обладают рядом характерных свойств, таких как низкая плотность, низкая температура плавления, мягкость, а также активность в реакциях с водой и кислородом.
Какие реакции между щелочными металлами и кислородом известны?
Самой распространенной реакцией является горение щелочных металлов в кислороде. Например, литий с голубым пламенем горит в кислороде, образуя оксид лития (Li2O).
Какие реакции щелочных металлов с водой известны?
Реакция щелочных металлов с водой является очень активной и сопровождается выделением водорода и образованием гидроксидов соответствующих металлов. Например, натрий реагирует с водой, образуя гидроксид натрия (NaOH) и выделяя водород.
Какие использования имеют щелочные металлы?
Щелочные металлы имеют множество применений в различных областях. Например, натрий используется в производстве стекла, калий является важным элементом питания для растений, а литий используется в производстве аккумуляторов.
Чем можно объяснить активность щелочных металлов?
Активность щелочных металлов объясняется их низкой ионизационной энергией и большим радиусом. Это позволяет им с легкостью отдавать электроны и образовывать ионы с положительным зарядом, что делает их реактивными.
Какие вещества образуются при реакции щелочных металлов с кислородом или водой?
При реакции щелочных металлов с кислородом образуются оксиды соответствующих металлов. А при реакции с водой образуются гидроксиды. Например, при реакции натрия с водой образуется гидроксид натрия и выделяется водород.
