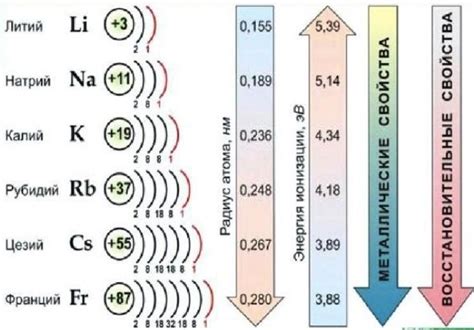
Щелочные металлы - это элементы первой группы периодической системы. В этой группе находятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют химические свойства, характерные для металлов - высокую пластичность, теплопроводность и электропроводность. Однако их электронное строение отличается от других металлов и, в особенности, от других элементов первого периода.
Схема электронного строения щелочного металла 1s22s22p1 обозначает, что у щелочных металлов внешний электрон находится в s-подуровне. Подуровни s-типа дают возможность элементу иметь 2 электрона, подуровни p-типа - 6 электронов. Таким образом, общее число электронов внешней оболочки щелочного металла равно 1. Это делает их очень реактивными элементами, которые легко отдают внешний электрон.
Это электронное строение определяет химические свойства щелочных металлов. Они имеют сильную склонность к образованию ионов с единичным положительным зарядом, так как отдают свой внешний электрон. Это свойство делает их отличными агентами для реакции с другими элементами. Вода или кислород, например, могут прямо взаимодействовать с литием или натрием, что приводит к образованию гидроксидов или оксидов.
Состав и структура щелочных металлов
Щелочные металлы представляют собой группу химических элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными металлами в периодической системе элементов и очень реактивными.
Схема электронного строения щелочных металлов состоит из двух энергетических уровней - внешнего s-уровня и внутреннего p-уровня. Все щелочные металлы имеют одну валентную электронную оболочку, содержащую один электрон в s-подуровне, и они характеризуются одной валентностью.
Щелочные металлы образуют ионы положительного заряда, потеряв один электрон, чтобы достичь электронной конфигурации инертного газа гелия. Например, натрий (Na) становится положительным ионом Na+, потеряв один электрон из своей валентной оболочки, чтобы получить электронную конфигурацию гелия.
Структура щелочных металлов имеет кубическую симметрию и формулу AB. Каждый атом металла окружен шестью атомами соседних металлов, образующих простую кубическую решетку. Эти атомы образуют жесткую структуру сильных металлических связей.
Щелочные металлы имеют низкую плотность, низкую температуру плавления и высокую электроотрицательность. Они хорошо проводят тепло и электричество и образуют сильные щелочные растворы в воде.
Схема электронного строения щелочных металлов
Щелочные металлы представляют группу элементов, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы относятся к первой группе периодической системы и характеризуются общими свойствами, такими как низкая плотность, низкая температура плавления, активность и реактивность.
Схема электронного строения щелочных металлов базируется на их полной внешней s-оболочке, которая представлена двумя электронами s-орбитали. Конфигурация электронов щелочных металлов обычно записывается в виде 2s^1, где 2s обозначает заполненную s-подоболочку до 2 электронов, а цифра 1 указывает на наличие одного электрона в этой самой s-оболочке.
Схема электронного строения щелочных металлов отражает их особенности в химических реакциях и взаимодействии с другими веществами. Имея один валентный электрон на внешней оболочке, щелочные металлы имеют большую склонность к потере этого электрона и образованию положительных ионов с единичным положительным зарядом, что делает их хорошими электронными донорами. Это свойство приводит к высокой активности щелочных металлов, а также к их способности реагировать с водой, кислородом и другими веществами.
Схема электронного строения щелочных металлов помогает понять их свойства и поведение в различных условиях. Эти элементы являются важными в химической промышленности, медицине, электронике и других сферах науки и технологий. Благодаря своей реактивности и способности образовывать стабильные соединения, щелочные металлы нашли широкое применение в различных областях и остаются важными компонентами нашей современной жизни.
С-электронная оболочка щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., имеют одну внешнюю s-электронную оболочку. Эта оболочка состоит из одного s-орбиталя, который может содержать максимум 2 электрона.
С-электронная оболочка является самой внешней оболочкой в электронном строении щелочных металлов. С-орбиталь имеет форму сферы и находится на большом расстоянии от ядра атома.
В щелочных металлах количество электронов в s-электронной оболочке равно 1, так как эти элементы находятся в первой группе периодической таблицы. Это означает, что внешняя оболочка щелочных металлов содержит только один s-электрон. Например, у лития один электрон в s-электронной оболочке, а у калия - одиннадцать.
Такое строение электронной оболочки щелочных металлов делает их очень реактивными. Они легко отдают свой единственный электрон, чтобы образовать положительный ион, и, таким образом, проявляют свою металлическую активность.
Суммируя, s-электронная оболочка щелочных металлов состоит из одного s-орбиталя, который может содержать максимум 2 электрона. Эта оболочка является самой внешней и содержит только один электрон, что делает щелочные металлы очень реактивными.
s-электронная оболочка щелочных металлов
Электронное строение атомов щелочных металлов характеризуется наличием s-электронной оболочки, которая содержит два электрона в 1s орбитали и один электрон в 2s орбитали.
Эта s-электронная оболочка является самой внешней оболочкой атома щелочного металла и определяет его химические свойства. Взаимодействие этих электронов с внешними атомами или ионами, а также с другими элементами, играет важную роль во многих химических реакциях и связано с высокой реакционной способностью щелочных металлов.
С-электронная оболочка щелочных металлов обладает высокой полярностью и устремленностью к потере своего дополнительного электрона. Это объясняется тем, что наружные электроны находятся на большом расстоянии от ядра атома и слабо привязаны, что делает их доступными для участия в химических реакциях.
С-электронная оболочка также определяет химическую активность щелочных металлов. Благодаря высокой реакционной способности и склонности к образованию ионов, эти элементы легко взаимодействуют с другими веществами, образуя соединения различных типов.
Электронная конфигурация щелочных металлов делает их мощными восстановителями и способными образовывать стабильные соли, оксиды и гидроксиды. Их реакционная способность приводит к образованию щелочных растворов, которые обладают базовыми свойствами и находят широкое применение в различных отраслях науки и промышленности.
p-электронная оболочка щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., имеют общую характеристику - наличие одного электрона в своей внешней электронной оболочке, обозначаемой как p-оболочка.
P-оболочка представляет собой вторую энергетическую оболочку, которая содержит 3 подоболочки - 2s, 2p_x и 2p_y. Каждая из этих подоболочек может содержать до 2 электронов, что делает общее количество электронов на p-оболочке равным шести.
Электроны на p-оболочке играют важную роль в химических свойствах щелочных металлов. Они активно участвуют в химических реакциях, образуя связи с другими атомами, чтобы достичь более стабильного энергетического состояния.
Характерной особенностью p-электронной оболочки щелочных металлов является ее активность в реакциях. Электроны на этой оболочке легко участвуют в обмене и образовании связей с электронами других атомов, что позволяет щелочным металлам образовывать различные соединения.
В целом, p-электронная оболочка щелочных металлов является ключевым фактором, определяющим их реакционную способность и химические свойства. Ее наличие и активность делают щелочные металлы важными элементами для различных областей науки и технологии.
Степень окисления щелочных металлов
Щелочные металлы - это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Особенностью этих элементов является наличие одного электрона во внешней энергетической оболочке.
Степень окисления щелочных металлов характеризует количество электронов, которые они могут отдать или принять при образовании соединений. Для щелочных металлов степень окисления обычно равна +1, так как они готовы отдать свой единственный электрон внешней оболочки.
Тем не менее, в некоторых соединениях щелочные металлы могут иметь степень окисления, отличную от +1. Например, в некоторых окисных соединениях, таких как пероксиды и супероксиды, степень окисления лития и натрия может быть +2 и +1.5 соответственно.
Также щелочные металлы могут принимать отрицательную степень окисления, когда они образуют соединения с более электроотрицательными элементами. В таких случаях, щелочные металлы играют роль катиона и покидают свой единственный электрон, что приводит к степени окисления +1.
В таблице ниже представлена степень окисления щелочных металлов в различных соединениях:
| Щелочный металл | Соединение | Степень окисления |
|---|---|---|
| Литий | LiCl | +1 |
| Натрий | Na2O | +1 |
| Калий | K2SO4 | +1 |
| Рубидий | RbF | +1 |
| Цезий | CsBr | +1 |
Таким образом, степень окисления щелочных металлов обычно равна +1, однако она может изменяться в зависимости от соответствующего соединения и окружающих условий.
Физические свойства щелочных металлов

Щелочные металлы – это элементы, которые относятся к первой группе периодической системы, их атомы имеют один электрон во внешней оболочке. Физические свойства этих металлов определяются их электронной структурой и химическими связями.
Первым физическим свойством щелочных металлов является низкая плотность. Благодаря этому свойству, некоторые из них, такие как литий и натрий, могут плавать на поверхности воды. Они проникают в воду и быстро реагируют с ней, образуя щелочные растворы.
Вторым важным физическим свойством щелочных металлов является низкая температура плавления. Калий и рубидий, например, плавятся при комнатной температуре, а цезий – при относительно низкой температуре 28 градусов Цельсия.
Третье физическое свойство щелочных металлов – высокая проводимость электричества и тепла. Электропроводность этих металлов в 10 раз выше, чем у других металлов. Именно поэтому они широко используются в электронике и электротехнике.
Кроме того, щелочные металлы обладают высокой реактивностью. Они реагируют с водой, кислородом и другими веществами. Например, калий оказывает сильное воздействие на воду, вызывая ее воспламенение, а цезий может взрываться при контакте с воздухом.
В заключение, щелочные металлы обладают рядом уникальных физических свойств, включая низкую плотность, низкую температуру плавления, высокую проводимость тепла и электричества, а также высокую реактивность. Именно благодаря этим свойствам, они находят широкое применение в различных отраслях науки и техники.
Вопрос-ответ
Какая общая схема электронного строения щелочного металла?
Общая схема электронного строения щелочного металла состоит из двух электронных оболочек: первой оболочки 1s и второй оболочки 2s и 2p.
Почему электронная формула щелочного металла имеет вид 1s22s22p1?
Электронная формула щелочного металла имеет вид 1s22s22p1, потому что первая оболочка заполняется двумя электронами (s-подуровень) и вторая оболочка заполняется шестью электронами (s- и p-подуровни). Таким образом, ущелочных металлов в второй оболочке остается один электрон в п-подуровне.
Какие элементы являются щелочными металлами и имеют такую электронную формулу?
Щелочными металлами являются элементы первой группы (IA) периодической системы, а именно: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У всех этих элементов электронная формула имеет вид 1s22s22p1.
Как заполняются электронные оболочки щелочных металлов?
При заполнении электронных оболочек щелочных металлов, первая оболочка заполняется двумя электронами (s-подуровень), а вторая оболочка заполняется шестью электронами (s- и p-подуровни). Таким образом, ущелочных металлов во второй оболочке остается один электрон в п-подуровне.
Почему щелочные металлы обладают высокой активностью?
Щелочные металлы обладают высокой активностью из-за наличия одного электрона во внешней оболочке, которое они легко отдают при взаимодействии с другими элементами. Это делает их очень реактивными и способными образовывать соли с различными ан-мионами.
Какова роль щелочных металлов в природе и технике?
Щелочные металлы имеют широкое применение в природе и технике. Они используются в производстве щелочей, взрывчатых веществ, стекла, металлов, лекарственных препаратов и других химических соединений. Литий и калий нашли применение в производстве аккумуляторов, а цезий в измерительных инструментах.

