В металлах, атомы образуют особый тип атомных связей, который называется металлической связью. Металлы характеризуются высокой проводимостью электрического тока и тепла, а также способностью быть изгибаемыми и прочными. И это все благодаря особенностям их атомных связей.
Металлическая связь возникает благодаря деликатному балансу между силой электростатического притяжения между атомами и отталкиванием их внутренних электронных облаков. В металлах, внешняя электронная оболочка атомов легко переходит с одного атома на другой, образуя так называемый "электронный газ". Это обуславливает множество уникальных свойств металлов.
Одним из основных свойств металлической связи является способность электронного газа проводить электрический ток. Под воздействием электрического поля, свободные электроны в металле начинают двигаться и образуют электрический ток. Более того, благодаря свободной подвижности электронов, металлы обладают отличными теплопроводными свойствами.
Кроме того, металлическая связь обеспечивает металлам еще одно важное свойство - их деформационную способность. В металлах, атомы расположены в решетке, причем силы связи между ними достаточно слабые. Из-за этого металлы легко деформируются под воздействием внешней силы, например, при изгибе или растяжении. Это свойство позволяет создавать из металлов разнообразные и прочные конструкции.
Типы атомных связей и их влияние

Атомные связи – это взаимодействия между атомами, которые определяют структуру и свойства вещества. Они могут быть различных типов и иметь разное влияние на свойства металлов.
Металлическая связь является одним из основных типов атомных связей, характерных для металлов. Она возникает благодаря общему движению электронов в металлической решетке. Это обуславливает такие характеристики металлов, как высокая теплопроводность и электропроводность, пластичность и деформируемость.
Ковалентная связь является типом связи, в которой электроны общаются между двумя атомами. Ковалентные связи, характерные для некоторых металлов, влияют на их твердость, плотность и температуру плавления. Они также определяют структуру металлической решетки и могут приводить к образованию различных типов кристаллических структур.
Ионная связь возникает между ионами разного заряда. В металлах, содержащих ионы, ионные связи влияют на их электропроводность, твердость и температуру плавления. Такие металлы могут быть хрупкими и иметь высокую температуру плавления.
Тип атомной связи и ее характеристики определяют свойства металлов и их применение в различных отраслях промышленности.
Металлы и атомные связи
Металлы характеризуются особыми свойствами, которые обусловлены особенностями атомных связей в их структуре. Атомные связи в металлах образуются благодаря обмену электронами между атомами. Однако, в отличие от неметаллических элементов, атомы металлов не образуют сильных ковалентных связей, а образуют так называемые металлические связи.
Металлические связи характеризуются высокой подвижностью электронов и упорядоченностью электронной структуры металла. В результате такой связи, электроны образуют так называемое "облако электронов", которое способно свободно двигаться по всей структуре металла. Благодаря этому, металлы обладают высокой электропроводностью и теплопроводностью.
Также, атомные связи в металлах обеспечивают высокую пластичность и формоизменяемость материала. Кристаллическая решетка металла обладает способностью деформироваться под действием малых внешних нагрузок, без разрушения структуры материала. Это позволяет металлам принимать различные формы, быть прокатанными и вытянутыми в проволоку.
Влияние атомных связей на свойства металлов можно наблюдать и в их механических свойствах. За счет особой структуры атомных связей, металлы обладают высокой твердостью и прочностью. Прочность, в частности, обеспечивается высокой степенью упорядоченности атомной структуры металла и возможностью перемещения дефектов.
Металлические связи и проводимость

Металлические связи - это особый тип атомных связей, характерный для металлов. Они возникают из-за наличия свободных электронов в зоне проводимости металла, которые могут свободно двигаться между атомами. Эти свободные электроны создают электронное облако вокруг катионов, обеспечивая сильное взаимодействие между атомами металла.
Из-за наличия свободных электронов, металлы обладают высокой электропроводностью. Электроны могут свободно двигаться по металлической структуре, образуя электрический ток. Это делает металлы отличными проводниками электричества и тепла.
Металлическая связь также обеспечивает характерные физические свойства металлов, такие как высокая пластичность и тугоплавкость. При воздействии внешних сил, свободные электроны позволяют атомам смещаться относительно друг друга без разрушения металлической структуры. Это объясняет способность металлов быть прочными и податливыми, что позволяет им быть использованными в различных промышленных и технических приложениях.
Металлические связи играют ключевую роль в определении химических и физических свойств металлов. Изучение этих связей помогает пояснить множество явлений, связанных с поведением металлов и их вкладом в различные отрасли науки и техники.
Ионные связи и кристаллическая структура
Ионные связи играют важную роль в формировании кристаллической структуры металлов. Это связи, которые образуются между ионами с противоположными зарядами. Ионы в металлах могут быть положительными (катионами) или отрицательными (анионами).
Кристаллическая структура металлов образуется благодаря взаимодействию ионов на разных уровнях. На первом уровне ионы образуют нейтральные частицы – кристаллические решетки. Кристаллические решетки являются основой для формирования кристаллической структуры металлов.
Ионные связи обладают рядом особенностей, которые влияют на свойства металлов. Одна из особенностей – сильная электростатическая привлекательная сила, которая держит ионы вместе. Благодаря этому связь между ионами обладает высокой энергией связи. Это делает связь стойкой и устойчивой к внешним воздействиям.
Кристаллическая структура, образованная ионными связями, обладает таким свойством, как хрупкость. Это связано с тем, что при деформации кристаллической структуры ионы с противоположными зарядами перемещаются и отклоняются друг от друга, что приводит к растрескиванию материала.
Таким образом, ионные связи и кристаллическая структура оказывают значительное влияние на свойства металлов. Они определяют прочность, пластичность, хрупкость и ряд других свойств материала. Понимание этих особенностей позволяет улучшать и модифицировать свойства металлов для различных применений.
Ковалентные связи и прочность металлов

Металлы обладают высокой прочностью, что делает их важными строительными материалами. Прочность металлов обусловлена наличием ковалентных связей между атомами.
Ковалентные связи формируются путем обмена электронами между атомами, что приводит к образованию сильных сил удерживающих атомы в кристаллической решетке. Эти связи могут быть одноатомными или многозарядными, в зависимости от количества валентных электронов.
Ковалентные связи обладают высокой энергией связи, что обуславливает прочность металлов. В кристаллической решетке металлов атомы расположены в упорядоченном и регулярном порядке, что позволяет им эффективно передавать механические нагрузки.
Кроме прочности, ковалентные связи также определяют другие свойства металлов, такие как пластичность и ударная вязкость. Связи между атомами позволяют им легко смещаться и деформироваться при воздействии внешних сил.
Таким образом, ковалентные связи являются основным фактором, обеспечивающим прочность металлов. Они обеспечивают структурную устойчивость и позволяют металлам сохранять свои механические свойства при различных условиях эксплуатации.
Межатомные взаимодействия и плотность металлов
Межатомные взаимодействия играют важную роль в определении физических и химических свойств металлов. Одним из основных факторов, влияющих на плотность металлов, является тип атомной связи, которая формируется между атомами в кристаллической решетке.
В металлах преобладает металлическая связь, при которой между атомами образуются электронные облака, которые свободно движутся по кристаллической решетке. Это обеспечивает высокую проводимость электричества и тепла у металлов. Кроме того, металлическая связь также отвечает за способность металлов быть хорошими проводниками электричества и тепла.
Металлическая связь также влияет на плотность металлов. Поскольку атомы металла могут свободно двигаться друг относительно друга, металлы имеют высокую плотность. Это связано с тем, что между атомами металла существуют сильные силы притяжения, которые определяют структуру металлической решетки.
Однако, не все металлы имеют одинаковую плотность. Плотность металлов зависит от таких факторов, как размер и масса атомов, число атомов в единице объема и степень упаковки атомов в кристаллической решетке. Например, металлы с большим размером атома и малой плотностью, такие как литий и натрий, имеют низкую плотность, тогда как металлы с малым размером атома и большой массой, такие как платина и иридий, имеют высокую плотность.
Гидридные связи и химическая активность
Гидридная связь является основным типом связи в металлах и играет важную роль в их химической активности. Она образуется между атомами металла и водорода, когда водородные атомы проникают в кристаллическую решетку металла и занимают определенные позиции. Гидридные связи могут быть как сильными, так и слабыми, что зависит от характеристик конкретного металла и его структуры.
Гидридные связи оказывают существенное влияние на химическую активность металлов. Водород, занимающий определенные позиции в кристаллической решетке металла, может участвовать в реакциях с другими веществами. Например, гидридные связи способствуют реакции металла с кислородом, образованию гидридов других элементов или реакции с водой.
Свойства металлов, такие как реакционная способность и способность к взаимодействию с другими веществами, также зависят от химической активности гидридных связей. Некоторые металлы имеют высокую химическую активность и легко вступают в реакции, в то время как другие металлы могут быть более пассивными и меньше подвержены воздействию окружающей среды.
Понимание гидридных связей и их влияния на химическую активность металлов позволяет улучшить их использование в различных областях, таких как энергетика, катализ и материаловедение. Дальнейшие исследования в этой области позволят разработать новые материалы с оптимальными свойствами и повысить эффективность их применения в различных процессах и технологиях.
Вопрос-ответ
Какие типы атомных связей встречаются у металлов?
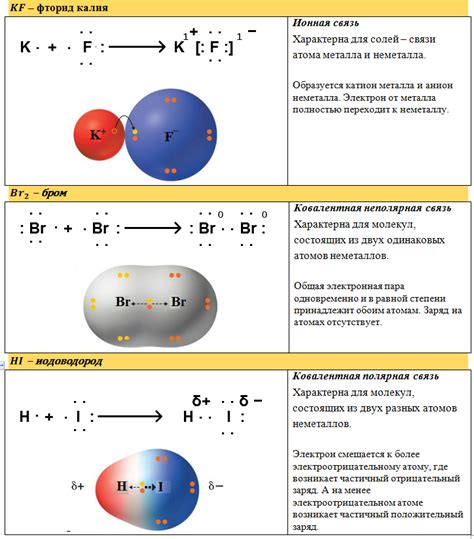
У металлов встречаются металлическая связь, ионная связь и ковалентная связь.
Что такое металлическая связь?
Металлическая связь - это связь между положительно заряженными металлическими ионами и свободными электронами, образующими электронное облако в кристаллической решетке металла.
Как влияет металлическая связь на свойства металлов?
Металлическая связь обеспечивает хорошую электропроводность, теплопроводность и пластичность металлов. Также она отвечает за способность металлов образовывать сплавы и иметь высокую точку плавления.
Чем отличается ионная связь от металлической связи?
В отличие от металлической связи, ионная связь возникает между ионами разных зарядов - катионами и анионами. Ионная связь характеризуется высокой электронной плотностью, что делает вещества с такой связью твёрдыми и хрупкими.
Какая связь присутствует в сплавах?
В сплавах присутствуют как металлическая, так и ковалентная связи. Металлическая связь отвечает за электропроводность и пластичность, а ковалентная связь - за прочность и стойкость к коррозии и окислению.
