Водород – это химический элемент с атомным номером 1 и символом H. Он является самым легким элементом в периодической системе, и его наличие присутствует во многих химических соединениях. Один из самых интересных аспектов взаимодействия водорода – это его соединение с оксидами металлов формулы. Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Встречается множество оксидов металлов с различными формулами, и каждый из них может реагировать с водородом, образуя новые соединения и разнообразные химические реакции.
Во время взаимодействия водорода с оксидами металлов формулы образуются соединения, называемые гидридами металлов. Гидриды металлов – это химические соединения, в которых водород выступает в роли отрицательного иона (гидрида). Образование гидридов металлов возможно благодаря реакции водорода и оксида металла, в результате которой оксид металла превращается в гидрид металла и образуется вода.
Основными закономерностями взаимодействия водорода с оксидами металлов формулы являются процессы окисления и восстановления. Во время реакции водорода с оксидами металлов ион водорода вступает в окислительно-восстановительные реакции, при которых оксид металла окисляется и водород восстанавливается. Такие реакции могут происходить как при нагревании смеси этих соединений, так и при их контакте без нагревания, но с использованием катализаторов.
Взаимодействие водорода с оксидами металлов

Водород - это наиболее легкий элемент в таблице химических элементов. Он обладает уникальными свойствами, такими как высокая горючесть и хорошая растворимость в воде. Также водород может образовывать соединения с другими элементами, включая металлы.
Оксиды металлов, в свою очередь, являются соединениями металлов с кислородом. Они образуются при окислении металлов или при воздействии кислорода на металл.
Взаимодействие водорода с оксидами металлов приводит к образованию гидроксидов металлов. Эта реакция называется гидролизом и является химической реакцией, при которой водород замещает кислород в оксиде металла, образуя гидроксид металла.
Примером такой реакции может служить взаимодействие водорода с оксидом натрия. При этом образуется гидроксид натрия и выделяется водород. Эта реакция представлена следующим уравнением:
- 2Na2O + 2H2 → 4NaOH + H2
Таким образом, взаимодействие водорода с оксидами металлов является важным процессом в химии и приводит к образованию гидроксидов металлов.
Основные закономерности
Взаимодействие водорода с оксидами металлов подчиняется определенным закономерностям, которые связаны с химическими свойствами этих соединений. Оксиды металлов могут быть кислотными, основными или амфотерными, и взаимодействие с водородом происходит в соответствии с их характером.
Кислотные оксиды реагируют с водородом при высоких температурах и образуют гидриды металлов, например, гидрид кремния SiH4. При этом водород выступает в роли восстановителя, а металл в оксиде – в роли окислителя.
Основные оксиды, в свою очередь, не реагируют с водородом при обычных условиях, так как они уже содержат в себе отрицательно заряженные гидроксильные группы. Но при нагревании они могут выделять из себя воду, сопровождаемую образованием соответствующего гидрида металла. Например, из оксида кальция CaO при нагревании выделяется вода, а оксид превращается в гидрид кальция CaH2.
Амфотерные оксиды взаимодействуют с водородом в различных условиях в зависимости от конкретных условий реакции и химических свойств оксида. Так, оксид алюминия Al2O3 может взаимодействовать с водородом при высоких температурах, образуя гидрид алюминия AlH3.
Химические реакции
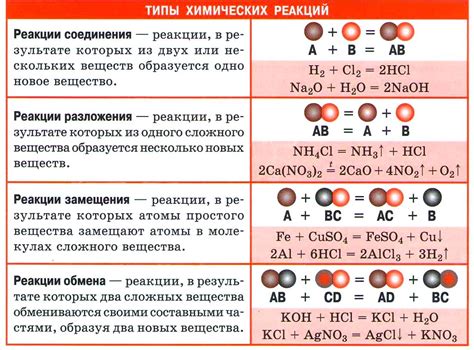
Взаимодействие водорода с оксидами металлов приводит к различным химическим реакциям, которые часто сопровождаются выделением энергии и образованием новых веществ.
Одной из основных реакций является обратимое взаимодействие водорода с оксидами металлов, при котором образуется вода. Например, в результате реакции водорода с оксидом железа (FeO) образуется вода (H2O) и металлическое железо (Fe). Уравнение реакции можно записать следующим образом: FeO + H2 → Fe + H2O.
Также возможна реакция водорода с оксидом алюминия (Al2O3), в результате которой образуется вода (H2O) и металлический алюминий (Al): Al2O3 + 3H2 → 2Al + 3H2O.
Химические реакции взаимодействия водорода с оксидами металлов могут протекать при различных условиях, включая наличие катализаторов, определенную температуру и давление. Кроме того, такие реакции могут иметь важное промышленное значение, например, при производстве водорода и металлов.
Формулы оксидов металлов
Оксиды металлов – это химические соединения, состоящие из металла и кислорода. Они имеют важное значение в химии и применяются в различных сферах, например, в производстве стекол, керамики, электродов и катализаторов.
Формула оксида металла зависит от заряда металла и его группы в таблице Менделеева. Например, в большинстве случаев, когда металл находится в I группе, его оксид имеет формулу MO, где M – металл. А если металл находится в II группе, то формула оксида будет M2O.
Однако есть исключения. Некоторые металлы, такие как железо, медь и олово, могут образовывать несколько различных оксидов с разным содержанием кислорода. Например, у железа есть FeO, Fe2O3 и Fe3O4.
Также следует отметить, что некоторые металлы могут образовывать положительные ионы с разным зарядом, что влияет на формулу оксида. Например, у железа оно может быть FeO или Fe2O3, в зависимости от заряда железа.
Следует отметить, что оксиды металлов могут обладать как кислотными свойствами (оксиды неметаллов), так и основными свойствами (оксиды металлов), что важно учитывать при изучении их химических реакций и применении в различных процессах.
Реакции восстановления

Реакции восстановления представляют собой химические процессы, в результате которых идет передача электронов от вещества, действующего в качестве восстановителя (восстанавливающего агента), к веществу, действующему в качестве окислителя (окисляющего агента). Взаимодействие водорода с оксидами металлов является одним из примеров реакций восстановления.
При реакциях восстановления водород играет роль восстановителя. Он участвует в передаче электронов, что приводит к образованию ионов водорода. Восстановление оксидов металлов ведется путем отщепления от них кислорода и присоединения водорода.
Основным условием проведения реакций восстановления оксидов металлов водородом является наличие активного вещества - восстановителя и нагревание системы. При нагревании происходит разрушение внутренних связей вокруг атомов кислорода, что обеспечивает их способность к взаимодействию с водородом.
Реакции восстановления водорода с оксидами металлов являются эндотермическими, т.е. сопровождаются поглощением тепла. В результате таких реакций образуются металлы и вода. Карбонаты металлов термически деструктивны и разлагаются на металл оксид и углекислый газ. Реакции восстановления широко используются в промышленности для получения металлических соединений и газов.
Важность взаимодействия водорода с оксидами металлов
Взаимодействие водорода с оксидами металлов является важным процессом в химических реакциях и промышленных процессах. Это объясняется рядом физико-химических свойств, которые обусловлены характеристиками водорода и оксидов металлов. Во-первых, водород является легкой и химически активной молекулой, способной образовывать водородные связи. Во-вторых, оксиды металлов обладают высокой электроотрицательностью и способностью кислотности.
Процесс взаимодействия водорода с оксидами металлов приводит к образованию гидридов металлов, которые обладают различными полезными свойствами. Например, некоторые гидриды металлов используются в качестве водородных накопителей, так как способны встраивать в себя большие объемы водорода и выделять его при необходимости. Такие материалы активно исследуются в связи с разработкой перспективных технологий водородной энергетики.
Важность взаимодействия водорода с оксидами металлов проявляется и в других областях промышленности. Например, реакции гидрирования, при которых оксиды металлов реагируют с водородом, широко применяются в производстве органических соединений, лекарственных препаратов и пищевых добавок. Благодаря этому, водород становится важным компонентом в различных химических процессах и инновационных технологиях.
Вопрос-ответ
Как водород взаимодействует с оксидами металлов?
Водород может взаимодействовать с оксидами металлов, образуя воду и металлический гидрид.
Какие основные закономерности можно наблюдать при взаимодействии водорода с оксидами металлов?
Одной из основных закономерностей является то, что взаимодействие водорода с оксидами металлов приводит к образованию воды и металлического гидрида.
Какие химические реакции происходят при взаимодействии водорода с оксидами металлов?
При взаимодействии водорода с оксидами металлов происходит химическая реакция, в результате которой образуется вода и металлический гидрид.
Какие металлические гидриды образуются при взаимодействии водорода с оксидами металлов?
При взаимодействии водорода с оксидами металлов образуется металлический гидрид, который зависит от конкретного металла и его оксида.
Как взаимодействие водорода с оксидами металлов может быть полезным в промышленности?
Взаимодействие водорода с оксидами металлов может быть полезным в промышленности, например, при производстве водородных топливных элементов.
Каково значение взаимодействия водорода с оксидами металлов в природе?
Взаимодействие водорода с оксидами металлов имеет большое значение в природе, так как является одной из причин образования воды и гидридов металлов.
Какие свойства имеют металлические гидриды, образующиеся при взаимодействии водорода с оксидами металлов?
Металлические гидриды, образующиеся при взаимодействии водорода с оксидами металлов, обладают различными свойствами, которые зависят от конкретного металла и его оксида.
